Тест с ответами по теме «Иммуноферментный анализ для определения состава биологически активных веществ в сыворотке крови»
Вашему вниманию представляется Тест с ответами по теме «Иммуноферментный анализ для определения состава биологически активных веществ в сыворотке крови» в рамках программы НМО: непрерывного медицинского образования для медицинских работников (врачи, медсестры и фармацевты).
Тест с ответами по теме «Иммуноферментный анализ для определения состава биологически активных веществ в сыворотке крови» в рамках программы НМО: непрерывного медицинского образования для медицинского персонала высшего и среднего звена (врачи, медицинские сестры и фармацевтические работники) позволяет успешнее подготовиться к итоговой аттестации и/или понять данную тему.
1. Антиген
1) блокирует функции генов;
2) вызывает выработку антител;+
3) вызывает реакцию отторжения;
4) способен расщепляться ферментами.
2. Антитела вырабатываются
1) В-лимфоцитами;+
2) Макрофагами;
3) Нейтрофилами;
4) Т-лимфоцитами.
3. Антитело – это
1) белок эпителиальных клеток, регулирующий регенерацию;
2) вещество с генетически чужеродной информацией;
3) вещество, стимулирующее иммунитет;
4) специальный гликопротеид, вырабатываемый для борьбы с антигеном.+
4. В основе иммуноферментного метода лежит взаимодействие
1) антитела с антигеном;+
2) комплемента с носителем;
3) преципитата с субстратом;
4) сыворотки с иммуноглобулином.
5. В случае ошибочного внесения двух опытных образцов в одну лунку планшета необходимо
1) забраковать лунку;+
2) промыть лунку 70% спиртом;
3) промыть лунку буферным раствором;
4) промыть лунку дистиллированной водой.
6. Вид контроля качества, выявляющего систематические ошибки
1) внешняя оценка качества;+
2) внутрилабораторный контроль качества;
3) международный контроль качества;
4) межлабораторный контроль качества.
7. Виды обязательного контроля качества для иммуноферментного анализа
1) внешняя оценка качества и внутрилабораторный контроль качества;+
2) внешняя оценка качества и межлабораторный контроль качества;
3) внутрилабораторный и международный контроль качества;
4) международный и межлабораторный контроль качества.
8. Внутрилабораторный контроль качества проводится
1) ежедневно;+
2) ежеквартально;
3) ежемесячно;
4) еженедельно.
9. Вошер в конце рабочего дня промывают
1) 70% спиртом;
2) дистиллированной водой;+
3) кислотой;
4) промывающим раствором.
10. Для остановки иммуноферментной реакции используют
1) кислоту;+
2) конъюгат;
3) субстрат;
4) щелочь.
11. Иммуноблот применяют в качестве подтверждающего теста для диагностики
1) ВИЧ-инфекции;+
2) Гепатита В;
3) Гепатита С;
4) Сифилиса.
12. Иммуноглобулины G (IgG)
1) в большом количестве содержатся в слизистых оболочках;
2) вторыми вырабатываются при иммунном ответе;+
3) обеспечивают противогельминтный иммунитет;
4) первыми вырабатываются при иммунном ответе.
13. Иммуноглобулины А (IgА)
1) в большом количестве содержатся в слизистых оболочках;+
2) вторыми вырабатываются при иммунном ответе;
3) обеспечивают противогельминтный иммунитет;
4) первыми вырабатываются при иммунном ответе.
14. Иммуноглобулины Е (IgЕ)
1) в большом количестве содержатся в слизистых оболочках;
2) вторыми вырабатываются при иммунном ответе;
3) обеспечивают противогельминтный иммунитет;+
4) первыми вырабатываются при иммунном ответе.
15. Иммуноглобулины М (IgM)
1) в большом количестве содержатся в слизистых оболочках;
2) вторыми вырабатываются при иммунном ответе;
3) обеспечивают противогельминтный иммунитет;
4) первыми вырабатываются при иммунном ответе.+
16. Иммуноферментный анализ изобретен в
1) 1951 году;
2) 1960 году;
3) 1971 году;+
4) 1980 году.
17. Инкубация в темном месте проходит с
1) конъюгатом;
2) промывающим раствором;
3) стоп-реагентом;
4) субстратом.+
18. На результаты иммуноферментного анализа влияет содержание в воздухе паров
1) перекиси водорода;+
2) спирта;
3) хлорсодержащих веществ;+
4) щелочи.
19. Необходимая температура воздуха в лаборатории иммуноферментного анализа
1) 12-15 ºС;
2) 18-25 ºС;+
3) 24-26 ºС;
4) 27-30 ºС.
20. Оптимальное время заполнения всех лунок планшета – в течение
1) 15-20 минут;+
2) 20-30 минут;
3) 30-60 минут;
4) 60-90 минут.
21. Основной вид биоматериала для исследования иммуноферментным методом
1) моча;
2) слюна;
3) сыворотка и плазма крови;+
4) эякулят.
22. Период времени для забора крови на иммуноферментный анализ
1) 10-12 часов;
2) 12-14 часов;
3) 5-6 часов;
4) 7-9 часов.+
23. Период голодания перед сдачей крови на иммуноферментный анализ
1) 10-12 часов;
2) 12-14 часов;
3) 4-6 часов;
4) 8-12 часов.+
24. Предшественник иммуноферментного анализа
1) иммунофлюоресцентный анализ;
2) радиоиммунный анализ;+
3) реакция агглютинации;
4) реакция связывания комплемента.
25. При инкубации в термостате допускается установка планшетов
1) в один ряд;+
2) друг на друга не более двух планшетов;
3) друг на друга не более трех планшетов;
4) друг на друга не более четырех планшетов.
26. При температуре -20 ºС сыворотка крови хранится
1) 10 суток;
2) 12 суток;
3) 15 суток;
4) 20 суток.+
27. При температуре от 2 до 8 ºС кровь хранится
1) 12 часов;
2) 24 часа;+
3) 6 часов;
4) 72 часа.
28. При температуре от 2 до 8 ºС сыворотка крови хранится
1) 12 часов;
2) 24 часа;
3) 6 часов;
4) 72 часа.+
29. Прибор, необходимый для проведения иммуноферментного анализа
1) биохимический анализатор;
2) проточный цитометр;
3) спектрофотометр;+
4) хроматограф.
30. Реагент для иммуноферментного анализа, содержащий ферментную метку
1) конъюгат;+
2) промывающий раствор;
3) стоп-реагент;
4) субстрат.
31. С целью диагностики аллергических заболеваний иммуноферментный анализ выявляет
1) IgE;+
2) IgG;
3) IgА;
4) IgМ.
Специальность для предварительного и итогового тестирования:
Лабораторная диагностика.
Уважаемые пользователи!
Каждый тест проходится вручную.
Это колоссальный труд авторов.
В это непростое время мы делаем все, чтобы сохранить Ваше время. Если хотите сказать Спасибо, то можете просто отправить ДОНАТ с любого Банка, КРОМЕ Сбера. Если у Вас только один Сбер, напишите автору, он подскажет как отправить ДОНАТ.
Спасибо, что Вы с нами!
1. Вид контроля качества, выявляющий систематические ошибки
1) внешняя оценка качества;+
2) внутрилабораторный;
3) международный;
4) межлабораторный.
2. Вид салфеток для процедуры взятия крови на исследование с применением гематологического анализатора
1) безворсовые;+
2) ватно-марлевые;
3) ворсистые;
4) марлевые.
3. Виды обязательного контроля качества для исследований на гематологическом анализаторе
1) внешняя оценка качества и внутрилабораторный;+
2) внешняя оценка качества и межлабораторный;
3) внутрилабораторный и международный;
4) международная и межлабораторный.
4. Внутрилабораторный контроль качества проводится
1) ежедневно;+
2) ежеквартально;
3) ежемесячно;
4) еженедельно.
5. Дифференцировку макроцитарной, микроцитарной и нормоцитарной анемии проводят по показателю
1) HCT;
2) MCH;
3) MCHC;
4) MCV.+
6. Каким реагентом заполняют систему гематологического анализатора при длительном перерыве в работе?
1) гемолитик;
2) изотонический разбавитель;
3) консервирующий раствор;+
4) промывающий раствор.
7. Количество лейкоцитов крови в норме, 109/л
1) 2,5-7,5;
2) 3,9-4,5;
3) 4-5;
4) 4-9.+
8. Количество ретикулоцитов в норме, промилле
1) 1,0-4,0;
2) 10,0-12,0;
3) 2,0-10,0;+
4) 4,0-9,0.
9. Концентрация спирта (%) для дезинфекции места прокола пальца при заборе крови с целью исследования на гематологическом анализаторе
1) 55;
2) 70;+
3) 90;
4) 96.
10. Метод подсчета, применяемый в 3 диф анализаторах
1) кинетический;
2) кондуктометрический;+
3) рассеивания;
4) фотометрический.
11. Норма гематокрита у женщин
1) 25-36;
2) 30-33;
3) 33-46;+
4) 38-49.
12. Норма гематокрита у мужчин
1) 25-36;
2) 30-33;
3) 33-46;
4) 38-49.+
13. Норма среднего содержания гемоглобина в эритроците, пг
1) 21-26;
2) 27-31;+
3) 33-37;
4) 40-47.
14. Норма средней концентрации гемоглобина в эритроците, г/л
1) 150-200;
2) 250-300;
3) 300-380;+
4) 390-450.
15. Нормальное количество эритроцитов в крови у женщин, 1012/л
1) 3,7-5,1;
2) 3,9-4,7;+
3) 4-5;
4) 4-9.
16. Нормальное количество эритроцитов в крови у мужчин, 1012/л
1) 3,7-5,1;
2) 3,9-4,7;
3) 4-5;+
4) 4-9.
17. Оптимальное количество переворачиваний вакуумной пробирки с кровью после взятия
1) 1-2;
2) 15-20;
3) 5-7;
4) 8-10.+
18. Оптимальный период голодания перед забором крови для гематологических исследований (часов)
1) 20-24;
2) 4-5;
3) 6 -7;
4) 8-12.+
19. Оптимальный период забора крови для гематологических исследований между (часы)
1) 10-12;
2) 12-14;
3) 6-7;
4) 7-9.+
20. Период хранения венозной крови при температуре 20 -25 ºС для исследования на гематологическом анализаторе (часы)
1) 2;
2) 4;
3) 6;+
4) 8.
21. Период хранения капиллярной крови при температуре 20 – 25 ºС для исследования на гематологическом анализаторе (часы)
1) 2;
2) 4;+
3) 6;
4) 8.
22. Период хранения крови при температуре 4 – 8 ºС для исследования на гематологическом анализаторе (часы)
1) 10;
2) 12;
3) 20;
4) 24.+
23. Показатель насыщения эритроцита гемоглобином
1) HCT;
2) MCH;
3) MCHC;+
4) MCV.
24. Показатель ошибок анализатора
1) HCT;
2) MCH;
3) MCHC;+
4) MCV.
25. Показатель среднего объема одного тромбоцита
1) MCH;
2) MPV;+
3) PDW;
4) PLT.
26. Показатель, указывающий на массу гемоглобина в одном эритроците
1) HCT;
2) MCH;+
3) MCHC;
4) MCV.
27. Предпочтительный антикоагулянт при подсчете форменных элементов
1) ЭДТА-содержащий алюминий;
2) ЭДТА-содержащий калий;+
3) ЭДТА-содержащий кальций;
4) ЭДТА-содержащий натрий.
28. Содержание гемоглобина в норме у женщин составляет, г/л
1) 110-120;
2) 120-140;+
3) 130-160;
4) 170-195.
29. Содержание гемоглобина в норме у мужчин составляет, г/л
1) 110-120;
2) 120-140;
3) 130-160;+
4) 170-195.
30. Средний объем эритроцита в норме, фм
1) 110-130;
2) 50-70;
3) 70-90;
4) 80-100.+
31. Типы гематологических анализаторов в зависимости от количества определяемых субпопуляций лейкоцитов
1) 1- и 2-диф;
2) 3- и 5-диф;+
3) 4- и 6-диф.
1. Вид контроля качества, выявляющий систематические ошибки
1) внешняя оценка качества;+
2) внутрилабораторный;
3) международный;
4) межлабораторный.
2. Вид салфеток для процедуры взятия крови на исследование с применением гематологического анализатора
1) безворсовые;+
2) ватно-марлевые;
3) ворсистые;
4) марлевые.
3. Виды обязательного контроля качества для исследований на гематологическом анализаторе
1) внешняя оценка качества и внутрилабораторный;+
2) внешняя оценка качества и межлабораторный;
3) внутрилабораторный и международный;
4) международная и межлабораторный.
4. Внутрилабораторный контроль качества проводится
1) ежедневно;+
2) ежеквартально;
3) ежемесячно;
4) еженедельно.
5. Дифференцировку макроцитарной, микроцитарной и нормоцитарной анемии проводят по показателю
1) HCT;
2) MCH;
3) MCHC;
4) MCV.+
6. Каким реагентом заполняют систему гематологического анализатора при длительном перерыве в работе?
1) гемолитик;
2) изотонический разбавитель;
3) консервирующий раствор;+
4) промывающий раствор.
7. Количество лейкоцитов крови в норме, 109/л
1) 2,5-7,5;
2) 3,9-4,5;
3) 4-5;
4) 4-9.+
8. Количество ретикулоцитов в норме, промилле
1) 1,0-4,0;
2) 10,0-12,0;
3) 2,0-10,0;+
4) 4,0-9,0.
9. Концентрация спирта (%) для дезинфекции места прокола пальца при заборе крови с целью исследования на гематологическом анализаторе
1) 55;
2) 70;+
3) 90;
4) 96.
10. Метод подсчета, применяемый в 3 диф анализаторах
1) кинетический;
2) кондуктометрический;+
3) рассеивания;
4) фотометрический.
11. Норма гематокрита у женщин
1) 25-36;
2) 30-33;
3) 33-46;+
4) 38-49.
12. Норма гематокрита у мужчин
1) 25-36;
2) 30-33;
3) 33-46;
4) 38-49.+
13. Норма среднего содержания гемоглобина в эритроците, пг
1) 21-26;
2) 27-31;+
3) 33-37;
4) 40-47.
14. Норма средней концентрации гемоглобина в эритроците, г/л
1) 150-200;
2) 250-300;
3) 300-380;+
4) 390-450.
15. Нормальное количество эритроцитов в крови у женщин, 1012/л
1) 3,7-5,1;
2) 3,9-4,7;+
3) 4-5;
4) 4-9.
16. Нормальное количество эритроцитов в крови у мужчин, 1012/л
1) 3,7-5,1;
2) 3,9-4,7;
3) 4-5;+
4) 4-9.
17. Оптимальное количество переворачиваний вакуумной пробирки с кровью после взятия
1) 1-2;
2) 15-20;
3) 5-7;
4) 8-10.+
18. Оптимальный период голодания перед забором крови для гематологических исследований (часов)
1) 20-24;
2) 4-5;
3) 6 -7;
4) 8-12.+
19. Оптимальный период забора крови для гематологических исследований между (часы)
1) 10-12;
2) 12-14;
3) 6-7;
4) 7-9.+
20. Период хранения венозной крови при температуре 20 -25 ºС для исследования на гематологическом анализаторе (часы)
1) 2;
2) 4;
3) 6;+
4) 8.
21. Период хранения капиллярной крови при температуре 20 – 25 ºС для исследования на гематологическом анализаторе (часы)
1) 2;
2) 4;+
3) 6;
4) 8.
22. Период хранения крови при температуре 4 – 8 ºС для исследования на гематологическом анализаторе (часы)
1) 10;
2) 12;
3) 20;
4) 24.+
23. Показатель насыщения эритроцита гемоглобином
1) HCT;
2) MCH;
3) MCHC;+
4) MCV.
24. Показатель ошибок анализатора
1) HCT;
2) MCH;
3) MCHC;+
4) MCV.
25. Показатель среднего объема одного тромбоцита
1) MCH;
2) MPV;+
3) PDW;
4) PLT.
26. Показатель, указывающий на массу гемоглобина в одном эритроците
1) HCT;
2) MCH;+
3) MCHC;
4) MCV.
27. Предпочтительный антикоагулянт при подсчете форменных элементов
1) ЭДТА-содержащий алюминий;
2) ЭДТА-содержащий калий;+
3) ЭДТА-содержащий кальций;
4) ЭДТА-содержащий натрий.
28. Содержание гемоглобина в норме у женщин составляет, г/л
1) 110-120;
2) 120-140;+
3) 130-160;
4) 170-195.
29. Содержание гемоглобина в норме у мужчин составляет, г/л
1) 110-120;
2) 120-140;
3) 130-160;+
4) 170-195.
30. Средний объем эритроцита в норме, фм
1) 110-130;
2) 50-70;
3) 70-90;
4) 80-100.+
31. Типы гематологических анализаторов в зависимости от количества определяемых субпопуляций лейкоцитов
1) 1- и 2-диф;
2) 3- и 5-диф;+
3) 4- и 6-диф.
Поделиться ссылкой:
Межлабораторный контроль качества позволяет выявить систематические и случайные ошибки при контрольных определениях. Существует два вида межлабораторного контроля качества:
- Краткосрочный контроль — лаборатории исследуют контрольный образец один день.
- Долгосрочный контроль — образец исследуется в течение нескольких дней.
После определения состава участвующих лабораторий контрольный центр рассылает контрольные образцы участникам.
После исследования контрольного материала участники посылают свои материалы в центр, где проводится статистическая обработка полученных результатов, составляется итоговый отчет — характеристика качества работы всех участников и индивидуальная оценка работы каждой лаборатории. Общая и индивидуальная оценка качества работы посылается каждому участнику контрольного эксперимента и в вышестоящие органы здравоохранения. Все лаборатории, независимо от производительности и штата, обязаны участвовать в межлабораторном контроле качества.
Требования к проведению межлабораторного контроля:
- Анализ контрольных проб включается в обычный ход работы лаборатории.
- Исследование контрольного материала выполняется тем же персоналом, который производит повседневные анализы.
- При анализе контрольных проб пользуются методом, который лаборатория использует в повседневной работе.
- Исполнитель не должен знать, что исследуемый материал — контрольный.
В межлабораторном контроле принимает участие не менее 20 лабораторий.
Программа контрольных исследований не должна быть слишком обширной, следует исследовать лишь несколько компонентов. Для проведения контроля используется материал по физико-химическим свойствам аналогичный клиническому материалу, стабильный при транспортировке и хранении в период проведения контроля. Используют жидкий, замороженный, лиофилизованный материал.
Перед исследованием контрольного материала следует внимательно познакомиться с инструкцией, при необходимости растворить его точным количеством дистиллированной воды, указанным на этикетке. Исследование проводить по приложенной программе.
При проведении краткосрочного эксперимента пробы исследуются однократно. При долгосрочном контроле пробы исследуют в течение нескольких дней, что позволяет оценить воспроизводимость каждой отдельной лаборатории. Все полученные результаты каждый день вносят на форменный бланк, присылаемый вместе с контрольной сывороткой. В конце последнего дня исследования бланк с контрольными результатами и указанием метода исследования пересылают почтой по адресу контрольного центра. Копия бланка остается в лаборатории.
В контрольном центре производится статистическая обработка результатов, выявляются случайные и систематические ошибки, т.е. оценивается воспроизводимость и правильность результатов исследования. Высчитывают среднюю арифметическую и среднеквадратическое отклонение по каждому компоненту, суммируя результаты всех лабораторий. Результаты, попавшие за пределы рассчитанного значения `X±2S исключают из расчетов, после чего повторяют статистическую обработку до тех пор, пока не остается ни одного результата, выходящего за пределы двух среднеквадратических отклонений.
Оценка работы отдельных лабораторий осуществляется путем сравнения значений, полученных лабораторией при исследовании контрольного материала с допустимыми пределами XСР±2S.
Если результат лаборатории укладывается в пределы XСР±2S, то он считается хорошим и оценивается двумя баллами. Если результат укладывается в пределах XСР±2S, то определение считается допустимым и оценивается в один балл. Остальные результаты считаются непригодными, оцениваются в ноль баллов. Подсчитав общее количество баллов по отдельным параметрам, оценивают работу каждой лаборатории.
В настоящее время разработана количественная оценка результатов отдельных лабораторий. Для этого результат каждой лаборатории выражают в единицах среднеквадратического отклонения по формуле:
где ХЛАБ — результат данной лаборатории;
ХМНОЖ — средняя арифметическая, полученная для всех результатов;
SМНОЖ — среднеквадратичное отклонение множества
Результаты внутри ±1JS — хорошие, внутри ±2JS — пригодные, более ±2JS — результаты непригодны.
В межлабораторном контроле качества наиболее хорошие результаты обычно имеют те лаборатории, в которых налажен внутрилабораторный контроль. Постоянное и повсеместное проведение внутрилабораторного контроля качества и участие в межлабораторном контроле имеет большое значение для стабилизации работы лаборатории, позволяет добиться воспроизводимости и правильности любого лабораторного исследования, что имеет значение для правильной диагностики и лечения.
Межлабораторный контроль качества.
Межлабораторные
эксперименты по контролю качества.
Лаборатории, систематически участвующие
в межлабораторных экспериментах по
контролю качества исследований,
могут использовать результаты
контроля для оценки качества своей
работы. Особенно ценными являются
долгосрочные контрольные опыты.
Цель
межлабораторного контроля качества:
выявление систематических и случайных
ошибок при контрольных определениях;
достижение сравнимых результатов,
получаемых участвующими лабораториями.
Анализ
контрольных проб должен включаться
в обычный ход работы лабораторий,
производиться тем же персоналом,
который выполняет повседневные
исследования, и принципиально теми же
методами, которые лаборатория использует
в повседневной практике.
Статистическая
обработка результатов исследования
участвующих лабораторий. Основная
цель статистической обработки —
определение пределов выполнения
контрольных исследований и выявление
систематических и случайных ошибок.
Статистическая обработка результатов
проводится для выявления погрешностей,
допущенных в работе лабораторий, и
для оценки сравнимости участвующих
лабораторий. Для этого производят
следующее.
1.
Результаты группируют по методам,
используемым для определения того
или иного компонента, и по типу системы
(ручной или автоматической). Цель —
снизить до минимума влияние различия
самих методов и иметь возможность
сравнения этих методов.
2.
В каждой группе рассчитывают: Х —
среднюю арифметическую величину; S
— среднеквадратическое отклонение.
Рассчитывают пределы Х±2S.
3.
Применяют метод исключения: все
результаты, попавшие за пределы X±2S,
исключают из дальнейших расчетов, а
остальные служат для повторного
вычисления новых средней арифметической
и среднеквадратического отклонения
(Xi и Si).
4.
Если после повторного пересчета найдутся
результаты вне пределов Хi±2Si,
то их также исключают, как и в первый
раз. Исключение и пересчет Х и S
повторяют до тех пор, пока во всем массиве
не будет ни одного результата, выходящего
за допустимые пределы Хп
± 2Sn. Вычисленные после
окончательного исключения средняя
арифметическая и среднеквадратическое
отклонение множества результатов служат
для оценки сравнимости всех лабораторий
в целом, а также для отдельных
лабораторий (в случае, когда используется
материал с неисследованным содержанием
компонентов).
Оценка
отдельных лабораторий. Результаты,
полученные из каждой лаборатории,
оценивают по отдельным параметрам путем
сравнения их значений с допускаемыми
пределами Х ± 2S,
рассчитанными для всего множества
результатов после окончательного
исключения. Критерием оценки могут
служить также паспортные данные
контрольного материала и результаты
референтной лаборатории. По результатам
контроля можно определить частоту
использования разных методов
исследования и сравнить их воспроизводимость.
В
настоящее время разработана количественная
оценка качества результатов отдельных
лабораторий.
Чем
ближе величина к нулю, тем лучше
сравнимость лаборатории с другими
участниками, тем лучше качество
результатов.
Указывая
результаты для отдельных лабораторий
и компонентов, можно классифицировать
все участвующие лаборатории по
качеству выполнения контрольных
исследований.
Метод
Юдена. Кроме статистической обработки,
возможно графическое изображение
результатов межлабораторного
исследования, которое позволяет
лаборатории сравнить свои данные с
результатами референтных лабораторий,
а также дает некоторое представление
о том, что ошибочно в методике, если
результаты непригодны. Для понимания
графика не требуется особых
статистических расчетов, но для
практического его использования каждой
лаборатории необходимо определить
компонент в двух контрольных образцах
(например, А и В). Методика построения
графика Юдена представлена на рис.
I. Строят систему координат, на оси
абсцисс откладывают действительное
значение компонента и интервалы
среднеквадратического отклонения (±2S)
для пробы А, на оси ординат — те же
показатели для пробы В. Действительные
значения компонентов и сигмы берут из
паспорта к контрольному материалу. Если
используется контрольный материал
с неисследованным содержанием
компонентов, в качестве действительных
величин используют Х и S множества
после исключений. Из двух точек Х и
У, представляющих действительные
значения компонента для пробы А и В
соответственно, проводят две взаимно
перпендикулярные прямые. Из точки
пересечения прямых проводят окружность
с радиусом, равным 2S. Прямую линию
W проводят под углом 45° через пересечение
средних прямых, деля нижний левый и
верхний правый квадраты. Две дополнительные
линии (S’ и t) проводят вдоль
периферии круга параллельно прямой W.
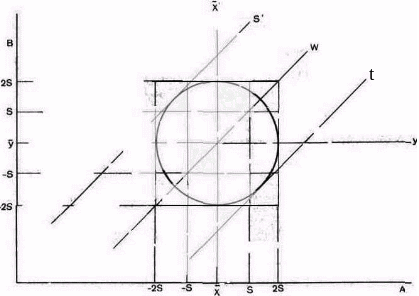
Рис.
1. График Юдена. На оси абсцисс — проба
А — контрольная сыворотка А; на оси
ординат — проба В — контрольная сыворотка
В. X—средняя арифметическая для пробы
А; Y—средняя арифметическая для пробы
В; XX’ и YY’—две взаимно перпендикулярные
прямые; S — среднеквадратическое
отклонение; W — прямая, которую проводят
под углом 45° через пересечение прямых
XX’ и YY’; S’ и t
— две касательные к окружности,
проведенные параллельно прямой W.
Точки,
попавшие в верхний левый и нижний правый
квадраты, указывают на случайные ошибки,
а попавшие в верхний правый и нижний
левый квадраты — на систематические
ошибки, допущенные лабораторией при
исследовании контрольных проб.
Пары
значений для А и В, полученные от каждого
участника, наносят в виде точек на
график. Еcли точки попали внутрь
окружности, результаты пригодны. Если
точки располагаются вне окружности, но
между параллельными прямыми, это значит,
что лаборатории получили завышенные
или заниженные величины для обеих
проб и что имеются систематические
ошибки. Точки, близкие к прямой W,
показывают, что лаборатория работает
стабильно. Точки, попавшие в другие
секции графика, не дают представления
о составе образца и свойственны случайным
ошибкам.
Таким
образом, график Юдена позволяет наглядно
дифференцировать систематические и
случайные ошибки, допущенные в работе
лабораторий, а также установить,
какие лаборатории работают в допустимых
пределах.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
