Быстрая и надежная диагностика злокачественных новообразований — одна из основных задач современной онкологии. На поздней стадии многие опухоли выявляются достаточно просто, но прогноз в этом случае чаще всего оказывается неблагоприятным. Основные трудности для диагностики представляют именно ранние или редкие формы онкологических заболеваний, при которых симптомы еще отсутствуют, а опухоль при этом активно растет и метастазирует.
Вне зависимости от того, на какой стадии заболевания врачам удалось установить диагноз, известие о наличии онкологического заболевания, как правило, оказывается шоком для самого пациента и его близких.
Чтобы сократить время, необходимое для назначения оптимального лечения (а значит, в конечном счете, улучшить прогноз), следует убедиться в том, что лечащий врач достаточно компетентен и способен в сжатые сроки определить необходимый объем диагностических исследований.
Насторожиться следует в случаях, когда врач не может однозначно и просто описать имеющуюся проблему и предлагает, например, провести хирургическую операцию для диагностики или, напротив, предлагает лечение без обследования, не объясняя, какими средствами и с какой целью будет проводиться терапия.
В этих случаях рекомендуется обратиться к другому онкологу для уточнения диагноза и получения так называемого «второго мнения». В распоряжении врачей, работающих в современных клиниках, сегодня имеется широкий арсенал средств для диагностики и лечения онкологических заболеваний, важно лишь правильно выбрать место лечения и доктора, который обладает достаточной квалификацией для того, чтобы разобраться в проблемах конкретного пациента.
Также следует отметить, что лечение в специализированных медицинских центрах, работающих по самым современным протоколам, может оказаться более эффективным, нежели терапия по месту жительства, поскольку выбор препаратов для химиотерапии (равно как и других методов лечения) в таких клиниках, как правило, существенно шире.
Подозрение на рак — обследование
Для обследования пациента с подозрением на онкологическое заболевание или больного, диагноз которого уже установлен, но вызывает сомнения, могут применяться различные методы лабораторной и инструментальной диагностики.
Лабораторные общеклинические анализы показывают в основном неспецифические изменения. Особенно важны в онкологической практике показатели периферической крови и костного мозга, а именно — эритропоэз и изменения лейкоцитарной формулы. До 70–80% случаев рака сопровождаются гипохромной анемией с изменением формы и размеров эритроцитов. Количество лейкоцитов и степень их зрелости при разных заболеваниях значительно варьируют — от лейкопении до лейкоцитоза.
Рентгенодиагностика занимает одно из ведущих мест в онкологии, ее методы постоянно совершенствуются. Компьютерная, магнитно-резонансная томография и исследования с контрастом позволяют обнаружить опухоль и метастазы даже при небольших размерах.
Благодаря эндоскопическим методам можно провести детальный осмотр новообразования в полостях и полых органах, а также взять кусочек ткани на биопсию.
УЗИ чаще всего применяют в диагностике опухолей щитовидной и молочной желез, малого таза, брюшной полости и забрюшинного пространства, мягких тканей, лимфатических узлов. Это доступный и простой метод, чувствительность которого может достигать 90%. Под контролем УЗИ проводят аспирационную биопсию опухолей.
Гистологическое и цитологическое исследования позволяют установить морфологический диагноз, степень злокачественности процесса и выбрать подходящую тактику ведения пациентов. Без них в онкологии невозможно установить окончательный диагноз. Для обнаружения атипичных клеток на гистологический анализ берут кусочек ткани, полученный при биопсии или в ходе операции. Для цитологического исследования используется клеточный материал. На цитологии под микроскопом с высокой разрешающей способностью исследуют материал, полученный путем аспирации или отслаивания (эксфолиации) клеток. Его специально концентрируют, чтобы увеличить количество клеток в объеме материала. Его фиксируют, окрашивают и изучают под микроскопом на предмет атипичных клеток. Это позволяет провести дифференциальную диагностику между злокачественными и доброкачественными опухолями.
Уточняющие методы обследования
Существует ряд обследований, которые помогают уточнить онкологический диагноз в сомнительных случаях.
Иммунодиагностика позволяет обнаружить антигены опухолевых клеток, которые отличаются от нормальных клеточных антигенов. Кровь и моча пациента содержат опухолевые маркеры, их выявляют при помощи реагентов, содержащих специальные антитела, при реакции ИФА. Наибольшую практическую ценность имеют такие антигены, как α-фетопротеин, PSA, СА-125, раково-эмбриональный антиген, хорионический гонадотропин, трофобластический В-глобулин.
Уточняющие онкологический диагноз обследования чаще всего сложные и дорогостоящие, поэтому не применяются массово в качестве скрининга. Но они обладают высокой точностью и в спорных ситуациях помогают врачу поставить верный диагноз. Уточняющая диагностика необходима не для удовлетворения академического интереса лечебного учреждения или врача, она призвана разрешить серьёзные сомнения в диагнозе, которые не отмели традиционные и не столь дорогие исследования. Возможно, с её помощью удастся разрешить вопрос «рак или не рак» или подобрать лучшее – оптимальное лечение опухоли. В любом случае эти исследования – крайняя необходимость, без которой невозможно решить важнейший для жизни вопрос, и тогда цена процедуры – вопрос совсем не главный.
Важен комплексный подход к диагностике, когда на начальном этапе выполняется стандартное и утверждённое клиническими рекомендациями обследование, а далее, по мере необходимости – крайней диагностической необходимости, поэтапно проводятся дополнительные исследования. Не все сразу, а только после тщательного анализа информативности предыдущего этапа. Перед каждым обследованием врач должен рассказать, на какие важные для пациента вопросы он надеется получить ответ, какие варианты ответов возможны, какие трактовки результатов удовлетворят его и помогут пациенту скорее начать лечение.
Можно назначать всё известное науке, используя всю установленную в медицинском центре аппаратуру, но также можно делать только необходимое, в оптимальном объёме и в разумные сроки. Стоимость процедур очень важна, но не важнее жизни. Наша клиника может предложить оптимальный подход во всём – и в диагностике, и в лечении, тем более что у нас есть всё, что позволит сделать это быстро и очень качественно.
Онкология – область медицины, где для постановки точного диагноза требуется новейшее оборудование для медицинской визуализации и высокая квалификация врачей. При невыполнении этих условий часто ставятся ошибочные диагнозы. По статистике, 35% пациентов, которые приезжают в Израиль на лечение онкологии, уезжают домой здоровыми, т.к. израильские врачи не обнаруживают у них рака.
ТОП-5 ошибочных диагнозов при раке
Расскажем о распространенных ошибках в онкологических диагнозах.
- Диагноз 1: Рак молочной железы
Прием в клинике: Ихилов (Сураски)
Специализация — онкология молочной железы, онкохирургия и общая хирургия. Ведущий израильский хирург-онколог, заведующий отделением онкологической хирургии в МЦ Ихилов.
Рак молочной железы – распространенное онкологическое заболевание у женщин. Благодаря распространенности маммографии и УЗИ молочных желез эту опухоль сейчас выявляют на ранней стадии. Иногда эти исследования обнаруживают у женщин небольшие образования размером от 2 мм, которые могут и не переродиться в злокачественную опухоль. Нередки случаи, когда женщины проходят хирургические операции, без которых они могли бы обойтись. А иногда, при неправильно проведенном гистологическом анализе опухоли, неоправданно назначаются даже такие небезобидные исследования, как химиотерапия и лучевая терапия.
Преимущество в прохождении лечения у израильских профессоров – это усовершенствованные методы хирургии, позволяющие сохранить большую часть груди при РМЖ.
- Диагноз 2: Опухоли головного мозга
Прием в клинике: Ихилов (Сураски)
Специализация — нейрохирургия. Ведущий израильский врач, эксперт в лечении нейроонкологических заболеваний, в хирургическом удалении опухолей и прочих образований головного мозга. Заведующий нейрохирургическим отделением медицинского центра Ихилов.
По статистике, этот диагноз «рекордсмен» по числу ошибок, которое иногда доходит до 80%. Диагностика опухолей головного мозга проводится с помощью МРТ и компьютерной томографии. При их интерпретации и случаются ошибки, обусловленные недостаточным опытом и квалификацией врача. Порой за злокачественные опухоли принимаются гематомы или абсцессы головного мозга.
- Диагноз 3: Лимфомы
Прием в клинике: Ихилов (Сураски)
Специализация — гематология, онкология. Ведущий израильский врач по лечению злокачественных заболеваний крови. Заведующая дневным стационаром гематологического отделения МЦ Ихилов.
При лимфомах неправильные диагнозы ставятся примерно в 50% случаев. Причиной является неточно проведенный гистологический анализ опухоли. Лимфому нередко путают с воспалением лимфоузлов (лимфаденитом), который может быть вызван инфекционными заболеваниями. Иногда за лимфому принимают туберкулез, саркоидоз, дермоидные кисты, различные болезни печени. При этих заболеваниях возможно увеличение (гиперплазия) лимфоузлов.
- Диагноз 4: Саркомы
Прием в клинике: Ихилов (Сураски)
Специализация – онкология и радиотерапия, лечение и диагностика опухолей скелета и мягких тканей. Президент Общества онкологов и радиотерапевтов Израиля и заведующий отделением опухолей и мягких тканей МЦ Ихилов.
Забор биопсийного материала при саркомах кости должен выполняться командой специалистов. В эту команду входит рентгенолог, морфолог и хирург. Это условие соблюдается далеко не всегда. Поэтому часто патолог не может точно провести дифференциальную диагностику между различными видами опухолей. Процент диагностических ошибок при этом виде новообразований достигает 60%. Больным саркомами часто назначают лечение от остеомиелита – антибактериальную терапию. При этом болезнь продолжает прогрессировать. Дело в том, что рентгенологические проявления остеомиелита и саркомы Юинга похожи и различить эти заболевания может только опытный специалист.
- Диагноз 5: Рак кишечника
Прием в клинике: Хадасса
Специализация — хирургия. Ведущий израильский врач, эксперт в области лапароскопических техник, проведении эндоскопических операций. Заведующий отделением хирургии клиники Хадасса.
Рак толстой кишки не сложно диагностировать, однако и здесь часто происходят ошибки. Причина – в несвоевременной диагностике рака, симптомы которого напоминают множество других заболеваний, в том числе синдром раздраженного кишечника (СРК), неспецифический язвенный колит, геморрой и т.п. Пациентам часто не назначаются нужные исследования, и они проходят лечение одного из перечисленных заболеваний, теряя драгоценное время. При этом рак прогрессирует.
Обратитесь в Ассоциацию Врачей Израиля, чтобы записаться на прием к врачу, который специализируются на диагностике и лечении конкретного заболевания.
Почему онкологи совершают ошибки?
- Причина 1. Одинаковые симптомы указывают на разные болезни. Большое значение имеет правильный забор биопсии и морфологический анализ опухоли. Не каждый врач выполняет эту работу качественно. Поэтому нередки случаи, когда в одном лечебном учреждении у пациента обнаруживают злокачественную опухоль, а в другом – доброкачественную.
- Причина 2. Важную роль играет и точная расшифровка результатов инструментальных исследований. Например, чтобы научиться расшифровывать результаты ПЭТ-КТ, врач в Израиле проходит длительное и дорогостоящее обучение. Такая возможность есть не во всех странах мира.
- Причина 3. Бывает, что, обнаружив новообразование, онкологи не назначают пациенту всех необходимых исследований и спешат назначить лечение. В большинстве случаев такое лечение оказывается неправильным или вообще ненужным.
- Причина 4. Иногда речь идет о редкой опухоли, с которой онколог мог не сталкиваться на протяжении всей своей работы. Он может совершить диагностическую ошибку, если в данном лечебном учреждении нет практики получения независимого второго мнения или решения спорных вопросов на медицинском консилиуме.
Как проверить диагноз?
В Ассоциации врачей Израиля вы сможете получить второе мнение профессоров-онкологов по поводу поставленного диагноза. Если вы хотите, чтобы врач-консультант Ассоциации изучил медицинские документы и оценил шансы на точную диагностику в Израиле, заполните форму связи ниже. Мы ответим в течение 24 часов.
Содержание
- Точность метода МРТ
- Причины ошибок диагностики
- Достоверность ПЭТ КТ
- Как избежать постановки неправильного диагноза?
В случае с обследованием человеческого организма на наличие раковых заболеваний ни один из методов не может гарантировать 100% безошибочный результат. Для диагностики применяются ПЭТ КТ, МРТ, классическая КТ, УЗД — все они имеют свои плюсы и минусы. Рассмотрим более подробно МРТ и ПЭТ КТ. Могут ли они ошибаться? Если да, то каковы причины неверных результатов при диагностировании рака?
Точность метода МРТ

- характер контура патологии;
- однородность содержимого;
- степень накопления контрастного вещества.
Это позволяет косвенно определить характер опухоли: доброкачественная или злокачественная. Окончательно подтвердить диагноз может только биопсия, но чем выше квалификация врача, выполняющего расшифровку, тем меньше возможность ошибки. Если соблюдать все правила проведения процедуры, то результат будет корректным.
Причины ошибок диагностики
Ошибки при заключении могут быть следствием неправильного размещения пациента на столе томографа, его движений при сканировании или появления артефактов на снимках. На всех изображениях, полученных при МРТ, есть разного рода артефакты, но они в большинстве случаев легко распознаются специалистом. Однако в некоторых ситуациях они могут имитировать патологические состояния, что требует от врача внимательности при расшифровке изображений.
Причины ошибок можно условно разделить на три группы:
- неправильная подготовка пациента к обследованию;
- недостаточная квалификация врача, проводящего процедуру;
- подбор неверной методики диагностики.
Нарушения процесса исследования из-за пациента
Одной из основных причин неправильных результатов МРТ является нарушение процесса диагностики пациентом. Чтобы подобного не случилось, человек должен:
до начала обследования снять с себя предметы, в состав которых входит металл;
- проинформировать лечащего врача о присутствии в теле имплантов из металла;
- в процессе обследования не совершать никаких телодвижений (соблюдать полную неподвижность).
Последний пункт имеет особое значение для точности результата. Малейшие шевеления пациента приводят к смазанности изображения. Именно поэтому лежать нужно не двигаясь, а это непросто при условии, что процесс длится достаточно долго.
Неверно подобранная методика
МРТ часто не может отличить раковые клетки от отечной жидкости и поэтому выдает неверный результат. Не всегда данный метод обследования может распознать опухоль головного мозга, а также легких из-за высокой воздушности и небольшого количества воды в тканях органов дыхания. Изучить состояние костных структур, используя МРТ, также не получится.
Для выявления новообразований лучше применить КТ. Компьютерная томография отлично справляется с поиском опухолей молочной железы и желудка, а МСКТ способна обнаружить образования величиной 2-3 мм.
Диагностические возможности аппарата напрямую зависят от его мощности. Снимки, полученные с помощью низкопольных установок, не обладают необходимой точностью. Для получения достоверных данных лучше применять оборудование с магнитным полем от 1,5 Тесла.
Недостаточная квалификация специалиста
Оборудование для МРТ очень точно воспроизводит изображение. Далее все снимки передаются рентгенологу, который должен их расшифровать. От его компетентности и уровня квалификации зависит постановка верного диагноза. Жировая клетчатка, мышцы, эпителий дают разный сигнал, поэтому иногда можно даже предположить из какой ткани состоит опухоль. К сожалению, многие врачи допускают ошибки в заключении из-за неверной расшифровки результатов.
Достоверность ПЭТ КТ
ПЭТ КТ (позитронно-эмиссионная томография, совмещенная с компьютерной томографией) — это исключительный способ радионуклидного обследования, при помощи которого осуществляется диагностика онкологических заболеваний, патологий ЦНС и эндокринной системы. Надежность исследования, в зависимости от исследуемого органа, колеблется в границах от 85 до 99%.
Несмотря на высокий процент точности, иногда ПЭТ КТ все же ошибается. Причиной этого являются разного рода объективные и субъективные факторы.
Основы работы метода

Датчики ПЭТ фиксируют повышенный обмен РФП, как «горячую зону». КТ в это время делает множественные снимки, тем самым указывая точное место локализации патологии. Изображения, выполненные с применением радиофармпрепарата, накладываются поверх срезов, которые были получены при КТ.
Используя метод ПЭТ КТ, можно получить точную оценку строения органов и патологических процессов, узнать их характеристики. При КТ, УЗД и МРТ подобный анализ провести невозможно.
Главные причины ошибок
В основе ошибок ПЭТ КТ лежат следующие причины:
параллельное существование еще одной патологии с аналогичными проявлениями;
- низкое разрешение аппарата ПЭТ КТ;
- заболевание находится на ранней стадии развития;
- телодвижения пациента во время процедуры;
- неправильная подготовка к диагностике;
- присутствие на теле или одежде обследуемого предметов из металла;
- повышенный сахар в крови;
- передвижения пациента в момент распределения РПФ в организме;
- неправильное толкование срезов специалистами.
Как избежать постановки неправильного диагноза?
Для того, чтобы в результате обследования получить правильный диагноз, необходимо:
- правильно подготовиться к предстоящему процессу;
- заранее снять все предметы, в состав которых входит металл;
- не совершать никакой активности во время распределения контраста по организму и в период исследования;
- проинформировать врача о наличии серьезных заболеваний (например, сахарный диабет);
- проходить процедуру в специализированных центрах с высококвалифицированным персоналом и качественным оборудованием.
Поделитесь с друьями!
С. Х. Аль-Шукри, С. Ю. Боровец, М. А. Рыбалов
Кафедра урологии Санкт-Петербургского государственного медицинского университета
имени акад. И. П. Павлова
В данном обзоре оцениваются преимущества и недостатки основных методов диагностики и
стадирования рака предстательной железы, приводятся сведения о современных высокотехнологичных методах стадирования и номограммах. Рассматриваются причины ошибок, возникающих
при диагностике и стадировании рака предстательной железы.
Ключевые слова: рак предстательной железы; диагностика; стадирование.
Введение
Повышение эффективности лечения рака предстательной железы (РПЖ) является одной из наиболее актуальных проблем современной урологии.
В мире РПЖ занимает 3–4 место в структуре заболеваемости злокачественными новообразованиями.
В России заболеваемость РПЖ в 2004 году составляла 6,9 %, а в 2009 году — уже 10,7 % [1]. При этом
за последние три десятилетия возросло число мужчин, умерших от этого заболевания [2].
I. МЕТОДЫ ДИАГНОСТИКИ РПЖ
Методы диагностики рпж — включают оценку
результатов пальцевого ректального исследования
(ПРИ), определении уровня ПСА в плазме крови.
Окончательный диагноз РПЖ может быть установлен только по результатам биопсии предстательной
железы, которую целесообразно выполнять под
ТРУЗ-контролем. При клиническом стадировании
для уточнения границ местного распространения
новообразования предстательной железы и для выявления местных и отдаленных метастазов в дополнение используют различные методы, позволяющие
получить изображение: компьютерную томографию
(КТ), магнитно-резонансную томографию (МРТ),
сцинтиграфию костей скелета и др. Однако результаты этих методов могут быть интерпретированы ошибочно как в пользу гипо, так и гипердиагностики.
Работы многих исследователей посвящены оптимизации скрининга и ранней диагностики РПЖ [3–5].
1.1. ПРИ. До внедрения в широкую клиническую практику ПСА, ПРИ было единственным
методом диагностики РПЖ. Большинство злокачественных новообразований РПЖ располагаются
в периферической зоне простаты и могут быть выявлены с помощью ПРИ, если их объем превышает
0,2 см 3. Положительная прогностическая ценность ПРИ варьирует от 4 % до 11 % у мужчин с уровнем ПСА от 0 до 2,9 нг/мл, и от 33 % до 83 % —
от 3 до 9,9 нг/мл и выше [6]. В связи с тем, что оба
этих метода имеют независимую друг от друга диагностическую ценность, рекомендовано применять
их комбинацию.
1.2. ПСА и его производные. Несмотря на то, что
уровень ПСА в плазме крови повышается при различных заболеваниях предстательной железы —
РПЖ, доброкачественной гиперплазии предстательной железы (ДГПЖ) и простатите, ПСА остается
практически единственным маркером, применяемым в целях ранней диагностики РПЖ. Однако
единых общепринятых международных стандартов
в отношении пороговых значений ПСА, которые
могли бы использоваться для диагностики РПЖ,
не существует [7]. Результаты недавнего исследования по профилактике РПЖ, проведенного в США,
подтвердили, что у многих мужчин РПЖ может
присутствовать, несмотря на низкий уровень ПСА
крови [8] (см. табл. 1).
При использовании более высоких условных
границ уровня ПСА (>4 нг/мл) для принятия решения о целесообразности проведении биопсии простаты повышается и риск пропустить клинически
значимый РПЖ; в тоже время при снижении этого
показателя (< 4 нг/мл) возрастает доля неоправданно выполненных биопсий простаты, когда новообразование отсутствует. До настоящего времени нет
данных литературы, которые позволили бы определить оптимальное пороговое значение ПСА, при
котором необходима биопсия простаты для выявления непальпируемого, но клинически значимого
РПЖ [9].
Таблица 1. Риск РПЖ при низком уровне ПСА в плазме крови
| Уровень ПСА, нг/мл | Риск РПЖ, % |
| 0-0,5 | 6,6 |
| 0,6–1 | 10,1 |
| 1,1–2 | 17,0 |
| 2,1–3 | 23,9 |
| 3,1–4 | 26,9 |
Производные ПСА — скорость нарастания и время удвоения ПСА — были предложены различными
исследователями [10, 11], однако при углубленном
изучении оказалось, что они не представляют большей ценности по сравнению с ПСА, и в настоящее
время не включены в клинические рекомендации
по диагностике РПЖ [9].
В отличие от них, расчет % свободного ПСА
оказался более значимым показателем, используемым преимущественно для выявления РПЖ у больных при значениях ПСА от 4 до 10 нг/мл и отрицательном результате ПРИ. РПЖ выявляют более
чем у половины мужчин с % свободного ПСА < 10,
в то время как при % свободного ПСА > 10 частота
выявляемости РПЖ на превышает 8 % [12].
1.3. PCA3. Относительно новый и интенсивно
исследуемый в настоящее время маркер — PCA3
(простатоспецифический некодирующий мРНК),
который определяют в осадке мочи после массажа простаты. Этот маркер имеет более высокую
чувствительность и специфичность по сравнению с ПСА, не зависит от объема простаты и наличия простатита у больного [13]. Сравнительно
небольшое число опубликованных работ по анализу диагностической ценности этого маркера
не позволяет рекомендовать его для широкого
использования в клинической практике. В связи
с этим в настоящее время этот маркер можно рассматривать как экспериментальный метод диагностики РПЖ.
1.4. ТРУЗИ. Классическая картина гипоэхогенного образования, расположенного в периферической зоне простаты, встречается не всегда, поэтому
ТРУЗИне относят к методам, позволяющим достоверно определять наличие РПЖ. ТРУЗ-контроль
получил широкое распространение при выполнении биопсии простаты.
1.5. Биопсия простаты. Биопсия предстательной железы является достоверным методом верификации диагноза РПЖ. Многими авторами были
предложены различные методики выполнения
этого исследования, отличающиеся по количеству
и участкам расположения биопсийных вколов.
При объёме ПЖ 30–40 см3 необходимо проводить
биопсию не менее чем из 8 точек. С увеличением
количества точек более 12, точность анализа существенно не изменяется [14]. На основании результатов Британского исследования по диагностике и лечению РПЖ была рекомендована биопсия
из 10 точек [15].
II. МЕТОДЫ СТАДИРОВАНИЯ РПЖ
2.1. ПРИ. Принято выделять клиническое стадирование, основанное на данных ПРИ, определении
уровня ПСА, рентгенологических, радиоизотопных
и других клинических методах исследования, а также патологоанатомическое стадирование, которое
становится возможным после морфологического
анализа удаленной предстательной железы, семенных пузырьков и лимфатических узлов. Патологоанатомическое стадирование более точно позволяет
оценить распространение болезни и судить о ее прогнозе. Наиболее важными патологоанатомическими прогностическим факторами после радикальной
простатэктомии являются степень дифференцировки новообразования, позитивный хирургический
край, экстракапсулярное распространение опухоли, ее инвазия в семенные пузырьки и метастазирование в тазовые лимфатические узлы. Сведения
об ошибках патологоанатомического стадирования
не включены в настоящий обзор литературы.
ПРИ позволяет определить не только наличие
РПЖ, но и степень его местного распространения.
Пальпируемая опухоль в простате — это признак,
характерный для низкодифференцированного РПЖ
(степень злокачественности по Gleason — 8–10 баллов). Чувствительность и воспроизводимость
ПРИ весьма низкие, что приводит как к недооценке, так и к переоценке степени распространения
РПЖ. Чувствительность метода при определении
клинической стадии РПЖ не превышает 30 % [16].
Стадия рака простаты правильно диагностируется
с помощью данного исследования менее чем в 50 %
случаев [17].
2.2. ПСА. Более высокий уровень ПСА в плазме крови косвенно указывает на большую степень
распространения РПЖ, но не позволяет достоверно
предсказать ни клиническую, ни патоморфологическую его стадию [18, 19].
2.3. ТРУЗИ позволяет выявить только 60 % опухолей простаты, остальные не распознаются из-за
эхогенности, сходной с таковой у окружающих
здоровых тканях. При этом остаются недиагностированными более 60 % РПЖ на стадии рТ3 [20].
ТРУЗИ в комбинации с цветной допплерографией
позволяет визуализировать проходящие через капсулу кровеносные сосуды, что типично при экстракапсулярном распространении новообразования
[21, 22]. Однако эта методика имеет низкую воспроизводимость, в связи с чем ее относят к категории
вспомогательных.
2.4. Биопсия простаты. По результатам биопсии простаты можно оценить степень местного распространения РПЖ, а также степень злокачественности новообразования в баллах по шкале Gleason.
Процент пораженной ткани — наиболее надежный
прогностический фактор риска инвазии опухоли
в семенные пузырьки и экстракапсулярного распространения новообразования.
2.5. КТ и МРТ недостаточно надежно позволяют
судить о степени распространения РПЖ, чтобы рекомендовать их как обязательные методы обследования. МРТ с эндоректальной катушкой позволяет
более точно определить стадию РПЖ и прорастание
опухоли в семенные пузырьки. Однако на фоне геморроидальных и воспалительных изменений ПЖ
или после ее биопсии интерпретация данных может
быть затруднена [9]. Сочетание контрастной МРТ
и МРТ в Т2‑режиме усиления и применение МРТспектроскопии позволяет лучше верифицировать
опухолевую ткань и диагностировать экстракапсулярное распространение опухоли [23].
Недостатки методов визуализации при РПЖ:
- Ложноотрицательные результаты из-за постбиопсийной крови.
- Артефакты от газа в прямой кишке, перистальтики.
- Ложноположительные очаги.
- Ложноотрицательные результаты ЭМРТ при
РПЖ с инвазией в прямую кишку. - Выявление РПЖ в центральной зоне.
- Невыявляемые очаги рака.
- Высокая зависимость от опыта рентгенолога.
Пути решения: - МРТ до биопсии или через 4 недели после нее.
- Подготовка пациента (микроклизма).
- Динамическое контрастирование.
- МРТ с поверхностной катушкой.
- МР-спектроскопия.
- Субспециализация.
2.6. Высокотехнологичные методы стадирования РПЖ. К новым перспективным методам, позволяющим получить изображение, можно отнести
ПЭТ, при помощи которого диагностируют около
70 % РПЖ на стадии рТ2 и pT3a‑4 [9]. При этом
очаг рака и микрометастазы < 5 мм остаются нераспознанными.
Наиболее перспективным методом визуализации является совмещённая позитронноэмиссионная/компьютерная томография. Этот
метод дает возможность за одно обследование получить информацию об анатомическом строении
и метаболических процессах. Метаболические
процессы (по результатам ПЭТ) здесь могут соотноситься с определенной анатомической локализацией (по данным КТ). Совмещённая позитронноэмиссионная/компьютерная томография имеет
более высокую точность разрешения — до 2 мм, однако также как и ПЭТ подразумевает использование специфичных для опухолевой ткани радиофармпрепаратов.
К современным ультразвуковым высокотехнологичным методам диагностики и стадирования РПЖ
относят эластографию и гистосканнинг.
Эластография — это неинвазивная методика,
используемая при диагностике опухолей, при которой оценивается степень жесткости (эластичность) мягких тканей. В основу методики положена
классическая методика пальпации объемных образований. Опухолевая ткань имеет коэффициент
жесткости до 28 раз превосходящий аналогичный
показатель здоровой ткани. В момент механической компрессии опухоль деформируется меньше,
чем окружающие ткани. При эластографии пальпация осуществляется посредством ультразвуковой
волны и механической компрессии. Программное
обеспечение ультразвукового аппарата обрабатывает принятый отраженный сигнал и воспроизводит
изображение на экране в формате цветного картирования, что позволяет дифференцировать ткани
в зависимости от эластичности. В результате более
плотные структуры тканей отображается оттенками
синего цвета, а легко сжимаемые эластичные участки маркируются красной цветовой шкалой. Результаты эластографии могут помочь в принятии решения о биопсии и выборе участка — «мишени» при
неоднозначных данных ПСА; использование данного метода возможно даже после повторных биопсий
предстательной железы. К недостаткам эластографии относят: высокую зависимость от опыта врача,
производящего исследование, сложность овладения
данным методом диагностики, а также низкая повторяемость результатов.
Гистосканнинг является еще одним новым высокотехнологичным методом ультразвуковой диагностики и стадирования рака предстательной железы.
Осуществляется дифференцировка между опухолевой и здоровой тканью, определение локализации
опухоли при малых ее размерах, невыявляемых с помощью стандартного ТРУЗИ. Чувствительность метода составляет 90 %, специфичность — 72 % [24].
В результате исследования получают информацию
о локализации зон, подозрительных на опухолевые,
что позволяет выполнить прицельную биопсию.
2.7. Номограммы. Большим числом групп исследователей были предложены разнообразные алгоритмы и номограммы для определения местного
распространения РПЖ, вероятности лимфогенного
метастазирования, а также принадлежности пациентов к прогностически неблагоприятной группе.
В основе метода — комплексная оценка результатов
ПРИ, уровня ПСА в плазме крови и степени дифференцировки новообразования. Одним из примеров
может быть индекс CAPRA, позволяющий оценить
вероятность безрецидивной выживаемости больных РПЖ на основании совокупности клинических
и морфологических критериев [25]. Использование
комбинации показателя уровня ПСА, индекса Глисона при биопсии простаты и клинической стадии Т
(номограмма Партина) дает лучшие результаты при
прогнозировании патоморфологической стадии,
чем каждый из параметров по отдельности [26].
2.8. N, M-стадирование. Тазовая лимфаденэктомия — золотой стандарт
определения метастазирования в лимфатические
узлы, N (открытым или лапароскопическим доступом).
М‑стадирование. У 85 % больных, умерших
от РПЖ, отмечают метастатическое поражение скелета [27]. Наличие и распространенность метастазов в кости позволяет определить прогноз в каждом
конкретном случае. Повышенный уровень щелочной фосфатазы, специфичной для костной ткани,
у 70 % может указывать на наличие метастазов в кости [28], однако наиболее чувствительным методом
исследования является остеосцинтиграфия. Помимо костей раковыми клетками могут быть поражены
отдаленные лимфоузлы, легкие, печень, головной
мозг, кожа. В зависимости от локализации отдаленных метастазов для их выявления при мягкотканой
локализации могут быть применены клинический
осмотр, рентгенография грудной клетки, УЗИ, КТ,
МРТ. При уровне ПСА в плазме крови >100 нг/мл
практически у всех больных имеют место отдаленные метастазы РПЖ [29].
III. Причины ошибок при
диагностике и стадировании РПЖ
Среди причин, приводящих к ошибкам при диагностике и стадировании РПЖ можно выделить
субъективные и объективные.
Субъективные:
- Недостаточная квалификация специалистов.
- Неправильная интерпретация данных обследования.
Объективные:
- Отсутствие высоко специфичных методов
диагностики. - Недостаточное использование современных
методов диагностики. - Неиспользование стандартных рекомендаций, предложенных Европейской ассоциацией урологов.
В заключении следует отметить, что в последние
годы предпринимаются попытки совершенствования
методов ранней диагностики и стадирования РПЖ.
Однако существует потребность в создании новых,
более точных методов, позволяющих выявлять клинически значимый РПЖ. К перспективным методам, позволяющим оптимизировать процессы диагностики и стадирования, можно отнести ПЭТ/КТ,
диффузионную МРТ, МР-спектроскопию, динамическую МРТ с повышением контраста. Необходима дальнейшая разработка специфичных для РПЖ
радиофармпрепаратов. Кроме того, важна унификация при интерпретации полученных данных — использование рекомендаций Европейской ассоциации урологов.
Список литературы
- Чиссов В. И., Русаков И. Г. Заболеваемость раком предстательной железы в Российской Федерации // Экспериментальная и клиническая урология. — 2011. — № 2–3. — С. 6–7.
- Quinn M., Babb P. Patterns and trends in prostate cancer incidence,
survival, prevalence and mortality. Part I: international comparisons
// B. J. U. Int. — 2002. — Vol. 90, N 2. — P. 162–173. - Ilic D., O’Connor D., Green S., Wilt T. J. Screening for prostate
cancer: a Cochrane systematic review // Cancer Causes Control.
— 2007. — Vol. 18, N 3. — P. 279–285. - Andriole G. L., Crawford E. D., Grubb R. L. 3rd. et al. Mortality results
from a randomized prostate-cancer screening trial // N. Engl.
J. Med. — 2009. — Vol. 360, N 13. — P. 1310–1319. - Schröder F. H., Hugosson J., Roobol M. J. et al. Screening
and prostate-cancer mortality in a randomized European
study // N. Engl. J. Med. — 2009. — Vol. 360, N 13. —
P. 1320–1328. - Schröder F. H., van der Maas P., Beemsterboer P. et al. Evaluation
of the digital rectal examination as a screening test for prostate
cancer. Rotterdam section of the European Randomized Study of
Screening for Prostate Cancer // J. Natl. Cancer Inst. — 1998. —
Vol. 90, N 23. — P. 1817–1823. - Semjonow A., Brandt B., Oberpenning F. et al. Discordance of
assay methods creates pitfalls for the interpretation of prostatespecific
antigen values // Prostate. — 1996. — Suppl. 7. —
P. 3–16. - Thompson I. M., Pauler D. K., Goodman P. J. et al. Prevalence
of prostate cancer among men with a prostate-specific antigen
level < or = 4.0 ng per milliliter // N. Engl. J. Med. — 2004. —
Vol. 350, N 22. — P. 2239–2246. - Heidenreich A., Bellmunt J., Bolla M. et al. EAU guidelines on
prostate cancer. Part 1: screening, diagnosis, and treatment of
clinically localised disease // Eur. Urol. — 2011. — Vol. 59,
N 1. — P. 61–71. - Carter H. B., Pearson J. D., Metter E. J. et al. Longitudinal evaluation
of prostate-specific antigen levels in men with and without
prostate disease // JAMA. — 1992. — Vol. 267, N 16. —
P. 2215–2220. - Schmid H.-P., McNeal J. E., Stamey T. A. Observations on the
doubling time of prostate cancer. The use of serial prostate-specific
antigen in patients with untreated disease as a measure of increasing cancer volume // Cancer. . 1993. . Vol. 71, N 6. .
P. 2031.2040. - Catalona W. J., Partin A. W., Slawin K. M. et al. Use of the percentage
of free prostate-specific antigen to enhance differentiation of
prostate cancer from benign prostatic disease: a prospective multicentre
clinical trial // JAMA. . 1998. . Vol. 279, N 19. .
P. 1542.1547. - Deras I. L., Aubin S. M., Blase A. et al. PCA3: a molecular urine assay
for predicting prostate biopsy outcome // J. Urol. . 2008. .
Vol. 179, N 4. . P. 1587.1592. - Eichler K., Hempel S., Wilby J. et al. Diagnostic value of systematic
biopsy methods in the investigation of prostate cancer:
a systematic review // J. Urol. . 2006. . Vol. 175, N 5. .
P. 1605.1612. - Donovan J., Hamdy F., Neal D. et al. Prostate Testing for Cancer
and Treatment (ProtecT) feasibility study // Health Technol. Assess.
. 2003. . Vol. 7, N 14. . P. 1.32. - Матвеев Б. П. Клиническая онкоурология. — М.: Вердана,
2003. — 717 с. - Spigelman S. S., McNeal J. E., Freiha F. S., Stamey T. A. Rectal
examination in volume determination of carcinoma of the prostate:
clinical and anatomical correlations // J. Urol. . 1986. .
Vol. 136, N 6. . P. 1228.1230. - Partin A. W., Carter H. B., Chan D. W. et al. Prostate specific antigen
in the staging of localized prostate cancer: influence of tumour
differentiation, tumour volume and benign hyperplasia //
J. Urol. . 1990. . Vol. 143, N 4. . P. 747.752. - Hudson M. A., Bahnson R. R., Catalona W. J. Clinical use of prostate
specific antigen in patients with prostate cancer // J. Urol. .
1989. . Vol. 142, N 4. . P. 1011.1017. - Enlund A., Pedersen K., Boeryd B., Varenhorst E. Transrectal
ultrasonography compared to histopathological assessment for
local staging of prostatic carcinoma // Acta Radiol. . 1990. .
Vol. 31, N 6. . P. 597.600. - Sauvain J. L., Palascak P., Bourscheid D. et al. Value of power
and 3D vascular sonography as a method for diagnosis and staging
of prostate cancer // Eur. Urol. . 2003. . Vol. 44, N 1. .
P. 21.30; discussion 30.31. - 22. Zalesky M., Urban M., Smerhovsky Z. et al. Value of power Doppler
sonography with 3D reconstruction in preoperative diagnostics
of extraprostatic tumor extension in clinically localized prostate
cancer // Int. J. Urol. . 2008. . Vol. 15, N 1. . P. 68.75;
discussion 75. - Fuchsjager M., Shukla-Dave A., Akin O. et al. Prostate cancer imaging
// Acta Radiol. . 2008. . Vol. 49, N 1. . P. 107.120. - Simmons L. A., Autier P., Zat’ura F. et al. Detection, localisation
and characterisation of prostate cancer by prostate HistoScanning
(.) // B. J. U. Int. . 2012. . Vol. 110, N 1. . P. 28.35. - Cooperberg M. R., Freedland S. J., Pasta D. J. et al. Multiinstitutional
validation of the UCSF cancer of the prostate risk assessment
for prediction of recurrence after radical prostatectomy //
Cancer. . 2006. . Vol. 107, N 10. . P. 2384.2391. - Partin A. W., Mangold L. A., Lamm D. M. et al. Contemporary update
of the prostate cancer staging nomograms (Partin Tables)
for the new millennium // Urology. . 2001. . Vol. 58, N 6. .
P. 843.848. - Whitmore W. F. Jr. Natural history and staging of prostate cancer //
Urol. Clin. North Am. . 1984. . Vol. 11, N 2. . P. 205.220. - Wolff J. M., Ittel T. H., Borchers H. et al. Metastatic workup of patients
with prostate cancer employing alkaline phosphatase and
skeletal alkaline phosphatase // Anticancer Res. . 1999. .
Vol. 19, N 4A. . P. 2653.2655. - Rana A., Karamanis K., Lucas M. G., Chisholm G. D. Identification
of metastatic disease by T category, Gleason score and serum PSA
level in patients with carcinoma of the prostate // Br. J. Urol. .
1992. . Vol. 69, N 3. . P. 277.281.
Журнал
О Втором мнении (second opinion) в медицине говорят тогда, когда результаты диагностических исследований отправляются на повторную консультацию к специалисту узкого профиля — эксперту в определенной области медицины. Такая консультация помогает подтвердить или опровергнуть первичный диагноз, сделать его более точным и детально разобраться в состоянии пациента. Чаще всего ко Второму мнению прибегают, когда у пациента выявляется онкологическое заболевание.
В развитых странах получение Второго мнения врача при раке довольно распространено. Ведь любой человек, оказавшись один на один с тяжелым заболеванием, прежде всего захочет получить консультацию опытного специалиста, который даст надежду на выздоровление и предложит наиболее современные способы лечения.
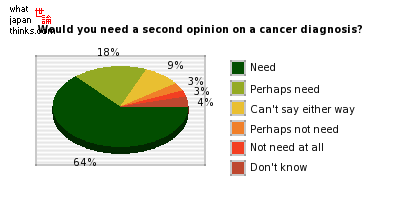
Социологический опрос в Японии: «Понадобилось бы вам второе мнение для диагностики рака?» Ответ в 64 % — ДА.
В России диагностика онкологических заболеваний зависит и от уровня оснащенности больниц, и от опыта врачей. Как правило, ошибки диагностики рака в маленьких городах связаны с общим невысоким уровнем медицинской помощи. Поэтому, если врач ставит неправильный диагноз — не спешите обвинять его во всех грехах. Лучше подумайте над тем, где получить консультацию более опытного и квалифицированного специалиста.
КТ и МРТ при раке — как повысить точность диагностики?
В наше время диагностика почти всех форм рака не обходится без современных лучевых методов, таких как компьютерная или магнитно-резонансная томография, маммография или ПЭТ. Эти методы позволяют выявить опухоль на ранних стадиях, точно определить ее размеры, положение, прорастание окружающих органов и другие важные детали. Но проблема состоит в том, что не все врачи одинаково хорошо владеют методикой анализа, чтения снимков. Разумеется, хороший специалист может оказаться в любой больнице, но нередко «обычные» рентгенологи слабо знают специфику онкологических болезней, и могут допустить ошибку. Поэтому, чтобы снизить риск врачебной ошибки, необходимо получить Второе мнение врача, который давно работает с онкологическими пациентами и хорошо разбирается в особенностях рентгенологической картины различных опухолевых заболеваний
Пересмотр КТ, МРТ и ПЭТ-КТ в онкологии
Врачи-онкологи уже привыкли к тому, что для правильной диагностики рака необходим пересмотр гистологических исследований (результатов биопсии). Ведь нужно точно ответить на вопрос, есть или нет признаков злокачественной опухоли на полученных гистологических срезах.
Аналогичным образом завоевывает популярность повторный анализ результатов КТ, МРТ или ПЭТ-КТ. Ведь правильная расшифровка снимков КТ или МРТ зачастую имеет решающее значение: с ее помощью точно устанавливается стадия рака, принимается решение о необходимости операции, планируется вид химиотерапии и т.п. Если онколог принимает ответственные решения, ему не обойтись без грамотного и четкого анализа снимков.
Зачем нужно второе мнение по КТ и МРТ?
Пересмотр снимков КТ, МРТ или ПЭТ узким специалистом-радиологом помогает решить следующие задачи:
- Достоверно выявить или исключить опухоль, правильно интерпретировать рентгенологические признаки
- Выявить объективные признаки доброкачественности или злокачественности опухоли
- Помочь онкологам правильно диагностировать стадию опухоли. Лучевые методы диагностики выявляют важные признаки, позволяющие уже на дооперационном этапе с большой долей уверенностью сказать, какую стадию имеет рак. Например, компьютерная томография при раке легкого выявляет размеры опухоли и прорастание бронхов, ПЭТ-КТ при раке молочной железы выявляет пораженные метастазами лимфоузлы. Точная оценка всех важных деталей невозможна без опытного взгляда диагноста, который специализируется на онкологических заболеваниях.
- Точно установить состояние окружающих органов, исключить прорастание опухоли в прилежащие сосуды, лимфатические узлы и другие структуры. Все эти подробности влияют на выбор вида операции, химио- и лучевой терапии
Как получить второе мнение по снимкам?
Заказать экспертную расшифровку КТ, МРТ или ПЭТ-КТ при подозрении на онкологическое заболевание можно в Национальной телерадиологической сети (НТРС) — системе удаленных консультаций врачей-радиологов, куда стекаются сложные случаи со всей России. Достаточно иметь запись исследования на диске. Консультация по снимкам МРТ или КТ осуществляется дистанционно: вы загружаете снимки с любого компьютера через сайт НТРС, и через 24 часа получаете заключение врача-рентгенолога с его подписью и печатью, с подробным описанием снимков и рекомендациями по дальнейшему обследованию. Консультируют специалисты из известных профильных центров: Институт хирургии Вишневского, Военно-медицинская академия, Институт мозга человека и т.п.
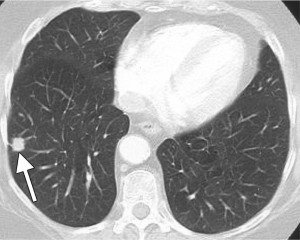
Компьютерная томография легких выявила очаговое образование нижней доли. Что оно собой представляет — рак, туберкулому, туберкулез или доброкачественную опухоль? Второе мнение с расшифровкой КТ опытным врачом-рентгенологом помогает решить эту проблему.
Что делать, если диагнозы не совпадают?
Нужно понимать, что окончательный диагноз ставится не рентгенологом, а лечащим врачом (хирургом, терапевтом, неврологом и т.д.). Однако зачастую результаты лучевых исследований (рентгена, КТ, МРТ, ПЭТ-КТ) очень часто играют ключевую роль при постановке диагноза. Получив заключение опытного рентгенолога, лечащий врач получит ценную информацию, которая поможет ему в определении формы и стадии рака, планирования операции, назначения химиотерапии и т.д.
Читать подробнее о Втором мнении
Читать подробнее о телемедицине
Кандидат медицинских наук, член Европейского общества радиологов









 до начала обследования снять с себя предметы, в состав которых входит металл;
до начала обследования снять с себя предметы, в состав которых входит металл; параллельное существование еще одной патологии с аналогичными проявлениями;
параллельное существование еще одной патологии с аналогичными проявлениями;