Типичные ошибки при проведении дефибрилляции
Доказано, что выживаемость при остановке кровообращения повышается при проведении дефибрилляции. Поскольку дефибриллятор — это прибор, представляющий повышенную опасность, существуют правила, которые надо соблюдать при работе с ним. Среди ошибок, которые допускают провайдеры при проведении дефибрилляции, можно выделить следующие:
Контакт с пострадавшим в момент разряда
Несоблюдение двухминутного интервала в оценке ритма и при проведении разрядов
Близкий контакт с источником кислорода в момента разряда
Повышение импеданса грудной клетки за счёт вентиляции перед разрядом
Проведение дополнительных циклов перед первым разрядом
Задержка разряда после остановки КГК
Проверка витальных функций после произведения разряда
Контакт с пострадавшим в момент разряда
Поражение электрическим током спасателей при проведении СЛР происходит достаточно редко. Однако, в момент проведения разряда возможен контакт третьих лиц с телом пациента. Таким образом, провайдер, работающий на дефибрилляторе, должен контролировать контакт с телом пациента перед нанесением разряда.
Несоблюдение двухминутного интервала
В 2015 году Международный согласительный комитет по реанимации (ILCOR) констатировал, что нет исследований, которые напрямую касаются вопроса оптимальных интервалов между проверками ритма и их влиянием на выживаемость, благоприятный функциональный и неврологический исход. На заседании комитета ILCOR было принято решение, в соответствии с принципом согласованности оставить интервал оценки ритма равный 2 минутам, как было в прошлой редакции рекомендаций Европейского совета по реанимации (ERC).
Близкий контакт с источником кислорода
При проведении разряда в среде, обогащенной кислородом, при появлении искрения под пластинами дефибриллятора при плохом контакте с поверхностью кожи, нельзя исключить возгорания кислорода, взрыва и получения ожога пациентом и медицинским персоналом («Влияние электродных гелей на появление искры при разряде»). На данный момент в литературе не описано случаев возгорания при дефибрилляции с использованием самоклеющихся электродов.
Риск возгорания во время проведения дефибрилляции может быть сведен к минимуму при использовании следующих мер предосторожности:
Самоклеющиеся электроды должны быть использованы во всех случаях, когда это возможно.
Кислородная маска или носовые канюли перед разрядом должны находиться на расстоянии не менее 1 метра от груди пациента.
Мешок для вентиляции может остаться подключенным к интубационной трубке или надгортанному устройству, если обеспечена герметичность дыхательной цепи и нет положительного давления конца выдоха (PEEP).
Если пациент подключен к аппарату искусственной вентиляции легких, и это не мешает КГК и не приводит к утечке дыхательной смеси, то можно продолжить вентиляцию не размыкая контура. Если в ходе КГК происходит утечка из дыхательного контура, необходимо перейти на вентиляции при помощи мешка АМБУ.
Тяжелобольных пациентов нуждающихся в PEEP можно оставить подключенными к аппарату ИВЛ на время проведения реанимации.
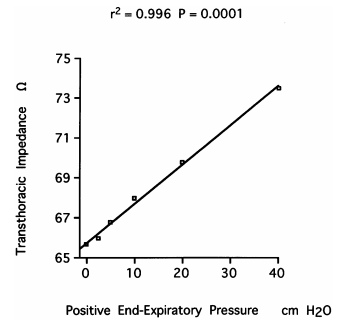
Вентиляция перед разрядом
Трансторакальный импеданс (сопротивление грудной клетки) имеет прямую зависимость от фазы дыхания. Минимальное значение сопротивления грудной клетки наблюдается в конце выдоха. Если возможно, именно в эту фазу должен быть произведен разряд. Положительное давление конца выдоха (PEEP) увеличивает трансторакальный импеданс. В исследовании посвященном «Влиянию положительного давления в конце выдоха на результат дефибрилляции» установлена линейная зависимость между PEEP и трансторокальным импедансом (TTI).
Таким образом, перед проведением разряда рекомендовано снижение PEEP и проведение разряда в момент максимального выдоха. При нарушении вентиляции или образовании дыхательной ловушки (Auto-PEEP), например, при приступе бронхиальной астмы, может потребоваться увеличение энергии разряда.
Линейная зависимость между PEEP и TTI
Проведение дополнительных циклов СЛР перед первым разрядом
Принципиально существует две стратегии при обнаружении дефибрилляционных ритмов:
Приоритетное нанесение разряда сразу после появления дефибриллятора с последующим началом СЛР.
Проведение нескольких циклов СЛР (2-3 минуты) перед разрядом для восстановления перфузии головного мозга и миокарда с последующей дефибрилляцией.
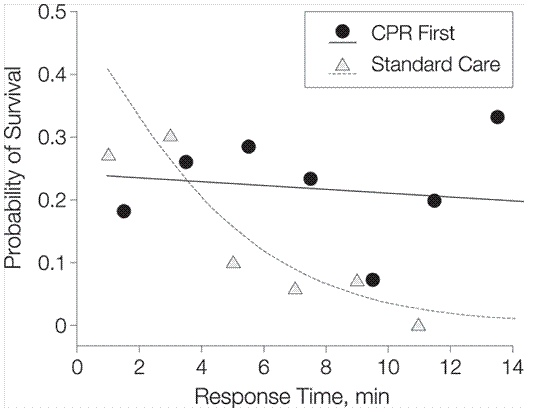
В исследовании, посвященном изучению задержки в дефибрилляции для проведения базовой сердечно-легочной реанимации у пациентов с фибрилляцией желудочков при внебольничных остановках («Delaying Defibrillation to Give Basic Cardiopulmonary Resuscitation to Patients With Out-of-Hospital Ventricular Fibrillation»), было показано, что преимущество той или иной стратегии зависит от времени первого контакта. Если помощь начинали оказывать раньше 5 минут с момента остановки, то преимуществом обладала стратегия первичного нанесения разряда (Standart Care). Если реанимация происходила спустя 5 минут от начала остановки, то несколько циклов компрессий с последующей дефибрилляцией имели большую эффективность (CPR First).
Вероятность дожития до выписки из больницы в зависимости от времени начала СЛР
Время начала СЛР разбито на двухминутные интервалы. Для каждого интервала рассчитана средняя доля выживших в группе пациентом, которым начали реанимацию в указанный момент времени. Сплошная и пунктирная линии показывают уменьшение выживаемости в зависимости от времени для каждой из 2 групп в отдельности.
В тоже время, в нескольких рандомизированных клинических исследованиях было показано, что у пациентов с внебольничными остановками с первоначальным ритмом на мониторе ФЖ/ЖТ без пульса, которым проводилась СЛР в течение 90-180 секунд перед разрядом, НЕ было преимуществ по сравнению с теми, кому дефибрилляция проводилась немедленно после доставки и активации дефибриллятора. Таким образом, дефибрилляция не должна задерживаться дольше, чем нужно для того, чтобы оценить ритм и набрать заряд на дефибрилляторе.
Рутинное проведение СЛР в течение нескольких минут перед первым разрядом НЕ рекомендуется.
Задержка разряда после остановки компрессий
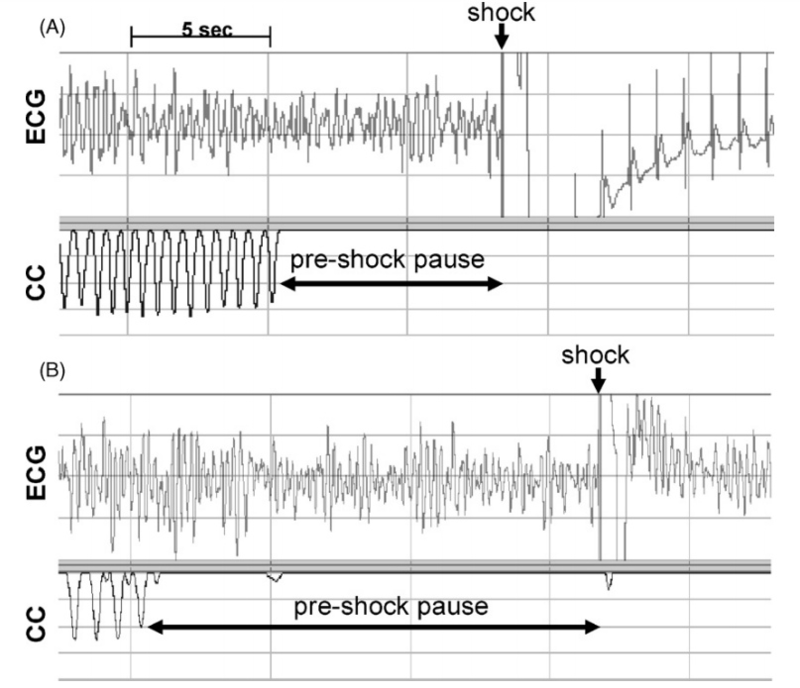
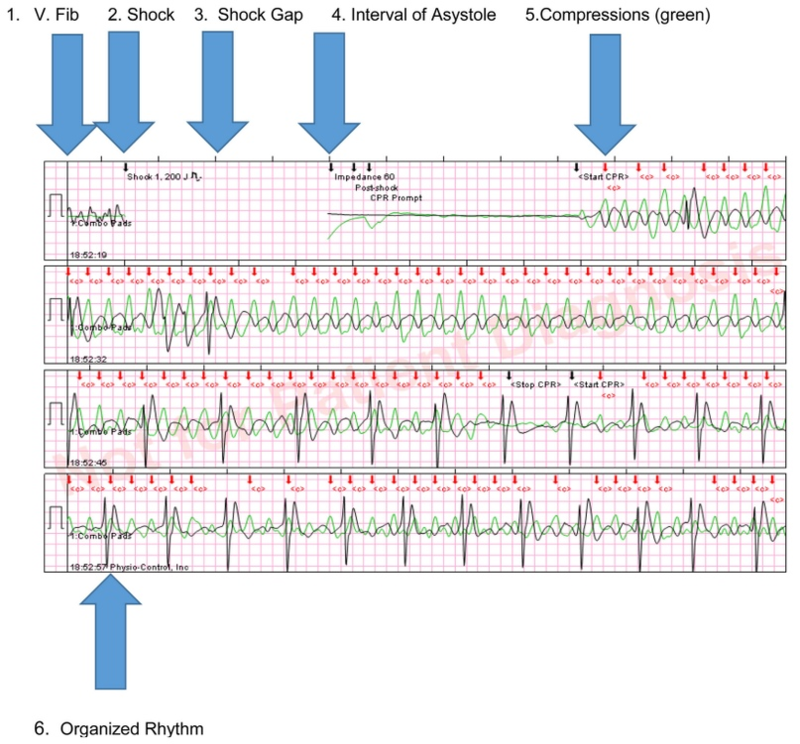
Дефибрилляция должна быть проведена как можно скорее. Даже перерыв 5-10 секунд от момента остановки компрессий до проведения разряда существенно уменьшает шансы на успешный исход. В исследовании по изучению «Зависимости между влиянием глубины компрессий и задержкой перед разрядом» на примере 60 пациентов было показано, что вероятность успешной дефибрилляции была выше, если предшоковая пауза была короче (11.9 s versus 22.7 s; p = 0.002). Кроме того, шанс повышался, если в предшествующие 30 секунд перед разрядом глубина компрессий была выше (39 ± 11 mm versus 29 ± 10 mm, p = 0.004).
Примеры попыток дефибрилляции
(А) При успешной попытки дефибрилляции пауза между разрядом и КГК составляла 8 секунд (B) при неудачной попытке пауза в компрессиях продолжалась 16 секунд, а глубина компрессий перед разрядом была меньше. ECG — электрокардиограмма. СС — компрессия грудной клетки.
Проверка витальных функций после нанесения разряда
После проведения разряда необходимо сразу продолжить СЛР (в соотношении 30:2) без оценки витальных функций. Даже если попытка дефибрилляции была успешной для восстановления перфузии требуется время; очень редко пульс пальпируется сразу после разряда.
После проведения разряда участник, проводящий дефибрилляцию, возвращает ложки на место, второй участник незамедлительно продолжает компрессии.
(1) Фибрилляция желудочков. (2) Дефибрилляция с энергией 200 Дж. (3) Постдефибрилляционная пауза (интервал после дефибрилляции, в котором ритм не может быть идентифицирован на ЭКГ). (4) Асистолия. (5) Возобновление КГК с последующим появлением организованной активности QRS во время нажатия на грудную клетку. (6) Постепенное увеличение скорости организованного ритма.
По материалам: European Resuscitation Council Guidelines for Resuscitation 2015
Пасечник И.Н., Скобелев Е.И., Рыбинцев В.Ю., Крылов В.В., Маркелов К.М.
ФГБУ ДПО «Центральная государственная медицинская академия» УД Президента РФ
Скачать статью (.pdf)
Определяя сердечно-легочную и мозговую реанимация (СЛМР) как комплекс методов интенсивной терапии, проводящихся при внезапной остановке сердца (ВОС) у пациентов с целью восстановления и поддержания утраченных функций кровообращения, дыхания и сознания, мы подразумеваем, что это — одна из важнейших проблем оказания помощи в ургентных ситуациях. Умение правильно проводить СЛМР важно для всех сотрудников, имеющих медицинское образование, т.к. оказание неотложной помощи входит в их должностные обязанности. При этом необходимо акцентировать внимание на двух аспектах: обязанность оказывать помощь и желание спасти человека. Ужесточение действующего законодательства является важным стимулом к совершенствованию навыков проведения СЛМР. Так же не стоит забывать об изменениях ментальности российского общества и иногда завышенных требованиях к медицинским работникам. Развитие современных средств связи и появление смартфонов позволяет фиксировать действия медицинских работников в аудио-видео формате и предъявлять обоснованные/необоснованные претензии. Объективную трактовку действий врача во время ургентной ситуации может дать только специалист, при этом важно понимать, что не всегда возможно оценить манипуляции, не попавшие в кадр. Однако негативный эмоциональный настрой свидетелей нередко приводит к обвинительной трактовке происшествия.
Желание спасти жизнь, свойственное любому нормальному человеку, а медицинскому работнику особенно, должно быть подкреплено устойчивыми навыками выполнения алгоритма СЛМР.
Методы СЛМР должны быть освоены и парамедиками – широким кругом специалистов, обязанных оказывать первую помощь. Вместе с тем, в РФ нет четкой трактовки, кто должен быть к ним отнесен.
В настоящий момент в России действует протокол СЛМР Европейского совета по реанимации в редакции 2015 года [1]. Релиз последнего протокола привел к корректировке программы обучения СЛМР в симуляционных центрах и других учебных заведениях страны. В ближайшее время ожидается пересмотр действующих рекомендаций, соответственно будут внесены изменения в программу подготовки специалистов.
Реализация существующего протокола СЛМР в РФ имеет ряд особенностей: низкий охват обучением населения, что связано с более поздним внедрением программ, дефицит автоматических наружных дефибрилляторов (АНД), несовершенство законодательства, регулирующего использование АНД, отсутствие единой диспетчерской службы по оказанию помощи при внезапной остановке сердца и др.
С учетом накопленного опыта и обобщения результатов СЛМР регулярно публикуются промежуточные консенсусы по протоколу СЛМР, последний был представлен в 2018 году. Принципиальных изменений он не содержит, по-прежнему акцент делается на компрессии грудной клетки и раннюю электрическую дефибрилляцию. Изменения внесены в разделы, посвященные антиаритмическим препаратам и системам жизнеобеспечения в педиатрической практике [2].
Доказательная медицина, приверженность к которой переживает взлеты и падения, плохо совместима с СЛМР. Протоколы оказания помощи в большей степени построены на мнениях и консенсусе экспертов. Это связано, прежде всего, с этическими проблемами и техническими трудностями. ВОС является плохо прогнозируемым событием, поэтому организовать проспективные исследования трудно, чаще всего используется ретроспективный анализ. Нельзя считать корректной и экстраполяцию данных, полученных на животных.
В большинстве ситуаций соблюдение протокола СЛМР зависит от ресурсной базы и степени подготовки специалистов, оказывающих помощь. В настоящий момент выделяют базовую и расширенную СЛМР, в англоязычной литературе они соответственно обозначаются как Basic Life Support (BLS) и Advanced Life Support (ALS). Использование англоязычной аббревиатуры, на наш взгляд, не совсем корректно, так как вводит курсантов в заблуждение, русскоязычные термины более приемлемы и практичны.
С учетом повышения доступности АНД во многих учебных заведениях и симуляционных центрах преподают промежуточный вариант протокола СЛМР, который обозначается как базовая СЛМР с использованием АНД, в англоязычной литературе — BLS+AED (automated external defibrillator). Переход на такую программу стоит признать прогрессивным и отвечающим велению времени. За рубежом повсеместно, а в РФ все чаще, АНД доступны. Причем АНД появились не только в местах массового скопления людей (аэропорты, крупные торговые точки, стадионы и др.), но и в гостиницах, самолетах. АНД стал неотъемлемым атрибутом отелей и помещается на видном месте наряду со средствами пожаротушения (рис. 1). Его использование определяется навыками окружающих и состоянием пострадавшего.

В настоящее время в РФ использовать АНД имеют право медицинские работники и лица, прошедшие специальную подготовку: сотрудники силовых структур, спасатели, водители транспортных средств и др. Вместе с тем, даже не все медицинские работники могут правильно применить АНД в ургентной ситуации, что обусловлено неустойчивыми навыками и/или стрессом. Утверждение законопроекта № 4669-77-7 позволит обучить широкие слои населения использованию АНД.
Критики повсеместного внедрения АНД в качестве аргумента чаще всего приводят возможность возникновения осложнений. Однако, на наш взгляд, это положение не состоятельно, т.к. нанесение электрического разряда в соответствии с заложенной в дефибрилляторе программой возможно только при регистрации АНД фибрилляции желудочков. Необходимость широкого внедрения АНД обусловлена еще и статистикой внезапной остановки сердца: до 70% случаев приходится на догоспитальный этап.
Проведение СЛМР имеет свои особенности в зависимости от места, где произошла ВОС: внебольничные условия или госпиталь. На догоспитальном этапе, как правило, реанимационные мероприятия начинают свидетели происшествия, в госпитальных условиях – медицинские работники.
Успешность оказания помощи при ВОС во внебольничных условиях во многом зависит от эффективности взаимодействия между диспетчером службы неотложной медицинской помощи и добровольцами, окружающими пациента. В реальной жизни информация, полученная от диспетчера, позволяет даже неподготовленным спасателям выполнять протокол СЛМР. Чаще всего на догоспитальном этапе проводится непрерывная компрессия грудной клетки с заданной частотой и глубиной (согласно рекомендациям — 100-120 нажатий в 1 мин на 5-6 см). Реже выполняется искусственная вентиляция легких (искусственное дыхание). Нанесение электрического разряда с помощью АНД в первые 3-5 мин после возникновения фибрилляции желудочков способно повысить выживаемость пострадавших на 50-70% [1]. В задачи диспетчера входит не только инструктирование спасателя по протоколу СЛМР, но и вызов бригады скорой медицинской помощи и помощь в доставке АНД. Необходимо заметить, что данных об эквивалентности полноценной СЛМР и СЛМР только с компрессиями грудной клетки не получено.
В работе, опубликованной в 2019 году, Riva G. и соавт. подчеркивается, что обучение населения и внедрение круглосуточных диспетчерских служб в Швеции привело к увеличению частоты оказания помощи на догоспитальном этапе в период с 2000 по 2017 годы с 40,8% до 68,2% от общего числа пострадавших [3]. Изолированная компрессия грудной клетки до приезда медицинской бригады сопровождалась 2-кратным увеличением выживаемости, а использование полноценного алгоритма СЛМР повышало выживаемость в 2,6 раза.
Как это ни парадоксально, но результаты СЛМР не всегда зависят от врачей анестезиологов-реаниматологов. Это связано с тем, что в большинстве случаев анестезиологи-реаниматологи приходят к пациенту с ВОС по вызову других специалистов (обычно это занимает не менее 5 минут) и продолжают (хуже, если начинают) реанимационные мероприятия. Поэтому эффективность лечения и выживаемость больных зависит от преемственности в оказании помощи. Во внебольничных условиях на начальном этапе помощь оказывают свидетели происшествия, а в стационарах – средний медицинский персонал и врачи нереанимационных специальностей. Такое положение дел позволяет утверждать, что повысить эффективность лечения при остановке кровообращения можно, прежде всего, за счет массового обучения широких слоев населения и поголовно всех медицинских работников. При этом мы априори считаем, что врачи анестезиологи-реаниматологи выполняют протокол СЛМР безукоризненно.
С момента появления доказательств об увеличении выживаемости больных с ВОС при повышении качества СЛМР, внимание специалистов приковано к проблемам обучения медицинских работников и волонтеров реанимационному пособию [4].
Поворотным моментом в обучении методам СЛМР в РФ можно считать 2012 год, когда стало развиваться симуляционное обучение. В программы среднего, высшего как додипломного, так и после дипломного образования были включены профильные циклы различной продолжительности [5, 6]. Одновременно с открытием симуляционных клиник значимо увеличилась и подготовка парамедиков.
Первоначальные ожидания снижения смертности от ВОС при появлении симуляционной медицины не оправдались. Это объясняется целым рядом причин: ограниченным числом обучаемых на первом этапе, дефицитом преподавателей и др. Как оказалось, не все медицинские работники горели желанием освоить методы СЛМР и посещали симуляционные центры лишь с экскурсионными целями. Стремление обучить как можно большое число курсантов приводило к низкому качеству их подготовки. Со временем стало понятно, что необходимо количественные показатели трансформировать в качественные. Не способствовало повышению качества оказания помощи и отсутствие системного подхода к обучению: навыки проведения СЛМР необходимо поддерживать постоянно. При отсутствии клинической практики компетенции специалистов угасают в течение 6-12 месяцев [7]. Наш опыт свидетельствует в пользу этих данных.
Наблюдался определенный диссонанс между реляциями о возрастающем количестве обученных СЛМР курсантов и сообщениями о летальных исходах, когда по сути медицинская помощь пострадавшим не оказывалась или оказывалась, но в недостаточном объеме.
Причин неудовлетворительного оказания медицинской помощи при ВОС много. Эта проблема характерна и для других стран. В РФ к клинической практике приступило только первое поколение врачей, которые обучались СЛМР не на бумаге, а в симуляционных центрах. Кроме того, достаточно остро стоит проблема сохранения навыков проведения СЛМР. После окончания учебного заведения средний медицинский персонал и врачи нередко возвращаются к поддержанию мануальных навыков лишь на сертификационных курсах, проводимых раз в пять лет. Необходимо в лечебных учреждениях иметь простейшие манекены для переподготовки специалистов через более короткие интервалы времени. Наша практика проведения регулярных ежегодных занятий, в том числе и выездных, с персоналом медицинских учреждений УД Президента РФ свидетельствует в пользу такого подхода [8].
Востребованность симуляционных центров определяется необходимостью отработки новых методик при обновлении протоколов и обучения людей, устраивающихся на работу в медицинские учреждение.
Еще одной проблемой является перенос знаний из симуляционной клиники в реальную клиническую практику. Почему-то считается, что воспроизведение навыков СЛМР у постели больного будет безукоризненным курсантами, сдавшими курс на отлично. Так ли это? Ответ содержится в уникальной работе, публикованной Wik L. и соавт. в 2005 году [9]. В проведенном исследовании оценили правильность реализации протокола СЛМР у 176 больных с ВОС (пациенты старше 18 лет). Исследование было международным и выполнялось в период с марта 2002 года по октябрь 2003 года в Стокгольме (Швеция), Лондоне (Англия) и Акершусе (Норвегия). Оценивали качество выполнения СЛМР анестезистами и специалистами со средним медицинским образованием – сотрудниками скорой медицинской помощи. Использовались модифицированные дефибрилляторы, оснащенные специальными накладками, содержащими акселерометр и датчик давления, второй акселерометр находился в дефибрилляторе. Это позволило объективно оценивать частоту и глубину компрессий грудной клетки с точностью ±1,6 мм, а также частоту искусственных вдохов. Информация о СЛМР сохранялась на специальных носителях и включала: сигналы ЭКГ и временные интервалы, сведения о компрессиях и искусственной вентиляции легких. Анализ полученных результатов по полноте выполнения действующего протокола СЛМР проводился с помощью компьютерных программ.
Перед началом исследования все участники прошли освежающий курс расширенной СЛМР (ALS). Сотрудники были поставлены в известность о проведении изучения эффективности СЛМР, однако им не были сообщены параметры контроля эффективности реанимационного пособия.
Полученные результаты не обрадовали участников исследования и организаторов. Неожиданным было, что 48% необходимого времени компрессии грудной клетки она не выполнялась. Даже после корректировки времени, затраченного на анализ электрокардиограммы и проведение электрической дефибрилляции, этот показатель составлял только 38%. Совсем неожиданными были цифры о глубине компрессий грудной клетки: в 72% случаев она была недостаточной. Лучше всего соблюдалась частота искусственной вентиляции легких. Восстановление кровообращения зарегистрировали у 61 пациента (35%), неврологический дефицит оставался у 5 из 6 пациентов, выписанных из стационара.
Из результатов исследования стало ясно, что протокол СЛМР не выполнялся по двум важнейшим компонентам — времени компрессий за минуту и глубине компрессий. Поэтому и показатели выживаемости были низкими. Доказано, что даже короткие 4-5 секундные паузы в компрессиях грудной клетки сопровождаются снижением коронарного перфузионного давления, что неблагоприятно сказывается на результатах СЛМР [10].
В моделях на животных и в процессе СЛМР у людей установлена взаимосвязь между повышением силы и глубины компрессий с одной стороны и коронарным кровотоком и артериальным давлением с другой [11, 12]. При сравнении с результатами, полученными в симуляционных залах, оказалось, что на манекенах чаще регистрируется избыточная глубина компрессий грудной клетки [13].
К причинам некорректного выполнения протокола СЛМР в реальных условиях относят: физическое и моральное напряжение реанимирующего, недостаточную подготовленность спасателей к работе в условиях стресса, утрату мануальных навыков при длительных перерывах в тренингах [9].
По нашему мнению, необходимо реформировать систему подготовки к оказанию помощи при внезапной остановке сердца. Особенно это касается курсантов, ранее обучавшихся. Мы сталкиваемся с ситуацией, когда на переподготовку приходят медицинские работники, способные правильно продемонстрировать мануальные навыки, необходимые при выполнении комплекса СЛМР, однако у них недостаточно развиты лидерские качества и способность работать в команде. Кроме того, изменение стандартной обстановки тренинга (ограниченные ресурсы, новые модели АНД и др.) приводит к снижению качества проводимых мероприятий. В процессе обучения важно представлять нестандартные сценарии, отрабатывать командное взаимодействие и повышать психологическую устойчивость курсантов. Значимым является отработка навыков СЛМР в условиях, приближенных к реальным. В нашем симуляционном центре имеются специальные классы, где можно имитировать обстановку катастроф: дымовая завеса, сирена, различные картины с происшествиями и др. При первоначальном знакомстве с такой аудиторией многие курсанты не сразу адаптируются к обстановке. Однако в дальнейшем такой тренинг позволит работать в нестандартной обстановке.
Кроме того, наши результаты свидетельствуют о недостаточной подготовленности медицинских работников нереанимационных специальностей к оказанию помощи при ВОС. В таблице 1 суммированы показатели тестирования врачей терапевтических специальностей на мастер-классах по СЛМР. Сразу оговоримся, эти данные имеют ряд особенностей: опрос и оценка навыков носили добровольный характер, что ограничивало выборку исследования.
Полученные результаты свидетельствуют: мануальная составляющая у медицинских работников нереанимационных специальностей при выполнении протокола СЛМР находится на низком уровне. В опросе участвовали сертифицированные специалисты, прошедшие подготовку по своей специальности на курсах повышения квалификации, подразумевающих наличие симуляционных практик.
При анализе собственных результатов и данных литературы можно выделить две категории ошибок: тактические и технические (манипуляционные) [6, 14, 15].
Главной тактической ошибкой является позднее начало реанимационных мероприятий, что свидетельствует о неготовности к оказанию помощи. Спасатель начинает реанимационные мероприятия с задержкой, после некоторой психологической борьбы с собой, надеясь, что кто-то придет ему на помощь и выполнит его работу. Обычно это проявляется в виде ненужных дополнительных диагностических мероприятий и организационной неразберихи. Тем самым теряется время, в течение которого помощь наиболее эффективна. Отсутствие выработанных на занятиях лидерских качеств не позволяет эффективно выполнять протокол СЛМР. Дополнительным фактором, мешающим работе, является присутствие посторонних лиц с не всегда предсказуемой реакцией на происшествие. Как это не парадоксально, но даже в стационарных условиях редко прослеживается командный подход.
Одной из причин такого положения дел – отсутствие разборов результатов СЛМР и контроля за написанием протоколов СЛМР в историях болезни. И здесь уместно вспомнить слова Питера Сафара (Peter Safar) о необходимости использовать каждый эпизод СЛМР для обучения персонала и совершенствования навыков проведения реанимационного пособия.
Как видно из таблицы 1 среди технических ошибок наиболее часто встречаются трудности с обеспечением проходимости дыхательных путей, задержка проведения электрической дефибрилляции, невозможность обеспечения венозного доступа для введения лекарственных препаратов. В 30-40% случаев регистрируются дефекты компрессии грудной клетки.
Недостаточное качество проведения СЛМР при широком охвате медицинских сотрудников симуляционными практикумами нельзя объяснить только дефектами подготовки. Необходимо констатировать, что не все спасатели способны мобилизоваться при возникновении критической ситуации. Вероятно, это связано с психологическими особенностями. СЛМР -это всегда стрессовая ситуация независимо от места и времени возникновения. Кроме того, не стоит забывать, что выполнение алгоритма СЛМР требует от спасателя колоссального физического напряжения. У людей, не занимающихся регулярно физическими тренировками и/или имеющих сопутствующую кардиальную патологию, проведение реанимационных мероприятий может сопровождаться подъемом артериального давления, нарушениями сердечного ритма и ишемией миокарда. Соответственно полноценное выполнение протокола СЛМР становится проблематичным.
Наибольшую нагрузку спасатель испытывает на начальном этапе (при одном реанимирующем), когда проводится компрессия грудной клетки и дыхание «рот ко рту». Даже подготовленный человек не выдержит более 10-15 минут. В этих условиях вероятность ошибок и неточностей крайне велика. Обеспечение проходимости дыхательных путей с помощью воздуховодов и вентиляция легких мешком Амбу снижают нагрузку на персонал.
В реальных условиях дефекты реанимации не связаны с одним фактором, как правило присутствует несколько компонентов: недостаточная подготовка, стрессовое состояние, плохая физическая форма спасателя и др.
К сожалению, несоблюдение протокола СЛМР сопровождается увеличением показателей летальности [16]. При детальном анализе качества оказания помощи было установлено, что независимо от вида остановки кровообращения (асистолия или фибрилляция) неполноценное реанимационное пособие приводило к повышению летальности среди пострадавших [17].
Личный опыт и данные литературы свидетельствуют, что на начальном этапе реанимационных мероприятий наибольшие трудности вызывает обеспечение проходимости дыхательных путей и искусственная вентиляция легких. Распространенным заблуждением было мнение о необходимости интубации трахеи как единственном варианте решения проблемы. Однако надо признать, что сейчас подходы к обеспечению проходимости дыхательных путей радикально изменились. В большинстве случаев интубация трахеи – удел анестезиологов-реаниматологов. Надежной альтернативой этой методике стала установка надгортанных воздуховодов, ее эффективность подтверждена во многих исследованиях.
В работе Benger J.R. и соавт. проведено сравнение эффективности обеспечения проходимости дыхательных путей на догоспитальном этапе [18]. Помощь при ВОС оказывали парамедики, прошедшие обучение по навыкам интубации трахеи и установки надгортанного воздуховода. У больных 1-й группы (n=4886) использовали надгортанный воздуховод, у пациентов 2-й группы (n=4410) проводили интубацию трахеи. Функциональные исходы пациентов через 30 суток после остановки сердца по группам не различались. Одинаковым было и количество случаев регургитации и аспирации желудочного содержимого.
В другом исследовании при ВОС сердца было показано, что использование надгортанного воздуховода ассоциировано с лучшим прогнозом по сравнению с интубацией трахеи [19]. Так в группе, где применили надгортанный воздуховод, были выше показатели 72-часовой и госпитальной выживаемости. Кроме того, использование надгортанного воздуховода сопровождалось меньшим неврологическим дефицитом на момент выписки. Полученные результаты позволяют считать применение надгортанных воздуховодов надежной альтернативой интубации трахеи.
Одной из методик, которая не получила в РФ широкого распространения, является измерение парциального давления углекислого газа на выдохе (ETCO2). С одной стороны, оценка этого показателя позволяет определить где находится интубационная трубка или правильно ли установлен надгортанный воздуховод, а с другой — оценить эффективность СЛМР.
Известно, что содержание СО2 в выдыхаемом воздухе является надежной характеристикой легочной перфузии и, соответственно, сердечного выброса. При дыхании СО2 элиминируется из крови в легких. Содержание СО2 можно легко измерить портативным капнографом, расположив его между концом эндотрахеальной трубки или надгортанного воздуховода и дыхательным мешком. Сообщается, что оценка СО2 может служить одним из критериев эффективности проведения СЛМР [20, 21]. В работе Kolar M. и соавт. было показано, что уровень ETCO2 после 20 минут реанимационных мероприятий при ВОС был достоверно ниже у больных с неблагоприятным исходом в сравнении с пациентами, у которых удалось восстановить сердечную деятельность, соответственно 6,9±2,2 мм рт.ст. и 32,8±9,1 мм рт.ст (p<0,001) [20]. Авторы считают, что если ETCO2 после 20 минут реанимационных мероприятий превышает 14,3 мм рт.ст., то вероятен благоприятный исход реанимационных мероприятий.
Необходимость проведения электрической дефибрилляции при фибрилляции желудочков сомнений не вызывает. Однако и здесь есть свои нюансы. Повсеместное использование АНД на догоспитальном этапе – благо. Однако мы прекрасно понимает, что работа АНД основана на компьютерной программе, которая не может пока сравниться со скоростью работы медицинского сотрудника. Даже при использовании АНД последних выпусков анализ электрической активности сердца и скорость нанесения разряда уступают человеку. При этом возрастает время, когда компрессии грудной клетки не выполняются. В недавнем исследовании это было подтверждено на практике. Использование АНД при ВОС в стационаре сопровождалось снижением выживаемости в сравнении с профессиональным дефибриллятором [22].
Наибольшие трудности во время СЛМР медицинский персонал испытывает при обеспечении венозного доступа. Однако, задержка введения адреналина на 5 минут сопровождается снижением выживаемости на 20% [23]. Среди врачей крайне низок процент специалистов, которые способны осуществить внутривенное введение лекарственного средства. Статистика по среднему медперсоналу более благоприятна. Кроме субъективных причин, имеются и объективные препятствия. В условиях остановки сердца доступ к венозной сети затруднен из-за уменьшения наполнения ее кровью и исчезновения ориентиров. Пункция и катетеризация центральных вен осуществляются только анестезиологами-реаниматологами ввиду наличия технических трудностей и возможности возникновения тяжелых осложнений.
Вот почему в последние десятилетия получило широкое распространение внутрикостное введение лекарственных средств [24]. По эффективности доставки препаратов оно не уступает внутривенному доступу, а по скорости и простоте обеспечения — превосходит. Основным препятствием для использования этой методики являлось отсутствие надежных приспособлений. Практически одновременно несколько лет назад в РФ были зарегистрированы два устройства, позволяющие обеспечить внутрикостный доступ: «дрель» и «шприц-пистолет». Первый способ энергозависим и требует наличия аккумулятора, что не всегда удобно, учитывая климатические особенности (низкие температуры) и необходимость контроля заряда.
Второй способ — энергонезависим и представляет собой шприц-пистолет, в котором проникновение стилета с катетером в кость достигается за счет металлической пружины. Имеются наборы для детей и взрослых, которые различаются по размерам и цветовой маркировке. Процесс обучения пользованию шприцом-пистолетом кратковременен и занимает не более 15 минут. При этом формируются устойчивые навыки. Для отработки практических навыков внутрикостного доступа имеются специальные учебные «симуляционные» наборы.
В соответствии с приказом МЗ РФ N36н от 22 января 2016 г. «Об утверждении требований к комплектации лекарственными препаратами и медицинскими изделиями укладок и наборов для оказания скорой медицинской помощи», набор для канюляции губчатых костей включен в состав укладок общепрофильной и реанимационной бригад скорой медицинской помощи.
Таким образом, совершенствование материальной базы делает процесс оказания помощи при ВОС более стандартизированным и прогнозируемым. Повышение выживаемости больных после ВОС, и тому пример — опыт зарубежных стран, может быть достигнуто только в условиях массового обучения населения и создания полноценной диспетчерской службы для консультации очевидцев происшествия по СЛМР в режиме реального времени. Обучение методам СЛМР необходимо проводить на манекенах с «обратной связью», позволяющей предотвратить некачественное обучение. Аппаратура, используемая в процессе тренингов не должна отличаться от той, с которой спасатель столкнется при оказании помощи в реальных условиях. На занятиях до 50% времени необходимо уделять формированию лидерских качеств курсантов и отработке коммуникативных навыков. Поддержание умений и компетенций необходимо регулярно осуществлять в тех учреждениях, где работает курсант. Для этого достаточно иметь простейшее оборудование. При выходе новых релизов рекомендаций по СЛМР отработку протоколов желательно осуществлять в симуляционныех центрах в соответствии с измененными программами тренингов.
СПИСОК ЛИТЕРАТУРЫ
- European Resuscitation Council Guidelines for Resuscitation 2015. 2015. – Vol. 95. – P. 1-80. doi: 10.1016/j.resuscitation.2015.07.038.
- Soar J, Donnino MW, Maconochie I, Aickin R, Atkins DL et al. 2018 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations Summary. Resuscitation. 2018;133:194-206. doi: 10.1016/j.resuscitation.2018.10.017.
- Riva G, Ringh M, Jonsson M, Svensson L et al. Survival in Out-of-Hospital Cardiac Arrest After Standard Cardiopulmonary Resuscitation or Chest Compressions Only Before Arrival of Emergency Medical Services: Nationwide Study During Three Guideline Periods. Circulation. 2019. doi: 10.1161/CIRCULATIONAHA.118.038179.
- Gallagher EJ, Lombardi G, Gennis P. Effectiveness of bystander cardiopulmonary resuscitation and survival following out-of-hospital cardiac arrest. JAMA. 1995;274:1922-1925.
- Евдокимов Е.А., Пасечник И.Н. Симуляционное обучение в анестезиологии и реаниматологии. В книге: Симуляционное обучение в медицине, под редакцией А.А. Свистунова. Москва, 2013. С. 144-165.
- Евдокимов Е.А., Пасечник И.Н., Скобелев Е.И. Симуляционное обучение и рекомендации по проведению реанимационных мероприятий: пересмотр 2015 года. // Медицинский алфавит. Неотложная медицина. – 2016. – Т. 2. — № 15. – С. 34-38.
- Donnelly P, Assar D, Lester C. A comparison of manikin CPR performance by lay persons trained in three variations of basic life support guidelines. Resuscitation. 2000;45:195-199.
- Репин И.Г., Пасечник И.Н., Крылов В.В. Тренинги in-situ в отдаленных санаторно-курортных учреждениях. Виртуальные технологии в медицине. 2017. № 2 (18). С. 34-35.
- Wik L., Kramer-Johansen J., Myklebust H. et al. Quality of cardiopulmonary resuscitation during out-of-hospital cardiac arrest. JAMA. 2005; 293(3):299-304.
- Berg RA, Sanders AB, Kern KB, Hilwig RW, Heidenreich JW, Porter ME, Ewy GA. Adverse hemodynamic effects of interrupting chest compressions for rescue breathing during cardiopulmonary resuscitation for ventricular fibrillation cardiac arrest. Circulation, 2001, 104: 2465–2470.
- Bellamy RF, Deguzman LR, Pedersen DS. Coronary blood flow during cardiopulmonary resuscitation in swine. Circulation, 1984, 69:174–180.
- Ornato JP, Levine RL, Young DS, Racht EM, Garnett AR, Gonzalez ER. The effect of applied chest compression force on systemic arterial pressure and end-tidal carbon dioxide concentration during CPR in human beings. Ann Emerg Med, 1989, 18:732–737.
- Liberman M, Lavoie A, Mulder D, et al: Cardiopulmonary resuscitation: Errors made by pre-hospital emergency medical personnel. Resuscitation, 1999; 42:47–55.
- Flannery AH, Parli SE. Medication Errors in Cardiopulmonary Arrest and Code-Related Situations. Am J Crit Care. 2016;25(1):12-20. doi: 10.4037/ajcc2016190.
- Di Mitri D, Schneider J, Specht M, Drachsler H. Detecting Mistakes in CPR Training with Multimodal Data and Neural Networks. Sensors (Basel). 2019;19(14). pii: E3099. doi: 10.3390/s19143099.
Обновлено: 08.06.2023
Электрическая дефибрилляция и кардиоверсия — немедикаментозный способ лечения некоторых видов сердечных аритмий путем нанесения кратковременного электрического разряда на область сердца. Это вызывает одномоментную деполяризацию мембран кардиомиоцитов и приводит к синхронизации процесса возбуждения миокарда.
Кардиоверсия — нанесение электрического разряда синхронизировано с комплексом QRS или зубцом R. Синхронизация необходима для того, чтобы разряд не попал на уязвимый период сердечного цикла (80 мс до, и 30 мс после, вершины зубца Т), поскольку в этом случае возможно развитие фибрилляции желудочков.
При дефибрилляции разряд наносится случайным образом по отношению к фазе сердечного цикла. С позиции здравого смысла применение дефибрилляции должно быть ограничено рамками сердечно-легочной реанимации. Но ситуации бывают разные. И иногда дефибрилляцию приходится применять по тем же показаниям, что и кардиоверсию. В этом случае всегда существует риск развития фибрилляции желудочков (около 0.4%). Повторная дефибрилляция, которую нужно провести в максимально короткие сроки, обычно восстанавливает ритм.
Дефибриллятор — это прибор, генерирующий электрический импульс нужной продолжительности и мощности (измеряется в Джоулях). По форме импульса дефибрилляторы делят на монофазные и бифазные. Последние считаются наиболее эффективными. Совет медикам: если вы не знаете, к какому типу устройств относится ваш дефибриллятор, считайте его монофазным.
Дефибрилляция
Проводится при перечисленных ниже нарушениях ритма. При проведении сердечно-легочной реанимации дефибрилляция при указанных нарушениях ритма должна быть выполнена как можно раньше. Если с момента фатального нарушения ритма сердца прошло более 3 минут, дефибрилляции должен предшествовать непрямой массаж сердца.
Дети: начальная мощность приблизительно 2 Дж/кг массы тела, повторная дефибрилляция — 4 Дж/кг массы тела.
Противопоказания: отказ от реанимационных мероприятий.
Показания для проведения дефибрилляции и рекомендуемая начальная мощность разряда для взрослых пациентов:
Мощность импульса в джоулях (Дж)
360 Дж или максимальной мощности
Полиморфная желудочковая тахикардия
Желудочковая тахикардия без пульса
Кардиоверсия
Показания
1.Фибрилляция (мерцательная аритмия) или трепетание предсердий
а. Фибрилляция или трепетание предсердий давностью более 48 ч (или неизвестной давности) при условии антикоагулянтной терапии в течение 3-4 недель с поддержанием MHO в диапазоне 2-3;
б. Пароксизм фибрилляции или трепетания предсердий, сопровождающийся нарушением гемодинамики или другими опасными состояниями:
- стенокардией;
- инфарктом миокарда;
- отеком легких;
- артериальной гипотонией;
- сердечной недостаточностью.
в. Фибрилляция или трепетание предсердий любой давности в отсутствие тромбов в левом предсердии и ушке левого предсердия по данным чреспищеводной ЭхоКГ;
г. Фибрилляция или трепетание предсердий давностью менее 48 ч (целесообразность антикоагулянтной терапии зависит от риска эмболических осложнений).
2. Предсердные тахикардии;
3. АВ-узловая реципрокная тахикардия;
4. Реципрокные тахикардии с участием дополнительных путей проведения.
Выбор начальной мощности разряда
Показания для проведения кардиоверсии и рекомендуемая начальная мощность разряда для взрослых пациентов:
Мощность импульса в джоулях
Стабильная мономорфная желудочковая тахикардия
Пароксизмальная наджелудочковая тахикардия
Противопоказания
1. Тромбы в предсердиях в отсутствие показаний к экстренной кардиоверсии;
2. Синусовая тахикардия;
3. Тахикардии, обусловленные повышенным автоматизмом:
- Политопная предсердная тахикардия;
- Ускоренный АВ-узловой ритм.
4. Гликозидная интоксикация;
5. Тяжелые электролитные нарушения в отсутствие показаний к экстренной кардиоверсии;
6. Фибрилляция предсердий неизвестной давности в отсутствие антикоагулянтной терапии и данных чреспищеводной ЭхоКГ;
7. Противопоказания к анестезии.
Подготовка к плановой кардиоверсии
- Пациент должен подписать согласие на проведение кардиоверсии;
- Перед проведением анестезии пациент в течение 4 часов не должен принимать пищу и жидкость;
- Больным перед плановой кардиоверсией показана чреспищеводная ЭхоКГ для выявления тромбов в левом предсердии. Стандартная ЭхоКГ в этом плане недостаточно информативна;
- Рекомендуется отмена сердечных гликозидов за 3-4 дня до процедуры;
- Уровень калия должен быть 4,0-5,0 ммоль/л.
Анестезиологическое обеспечение
Больные, которым проводится кардиоверсия, нуждаются в выключении сознания. Подготовка, предоперационное обследование, оснащение — общепринятые в анестезиологии. Мониторинг — стандартный. Особенности: внутривенная анестезия поверхностная и кратковременная — обратите внимание на рекомендуемые дозы анестетиков. Анестезия, как правило, проводится с сохранением спонтанного дыхания у больного.
Кардиоверсия производится, как только больной утрачивает сознание (плавающие глазные яблоки, утрата речевого контакта) — в условиях поверхностной анестезии. Из-за сниженного сердечного выброса время наступления анестезии может быть увеличено. Врачи не спешат увеличивать дозу анестетика больше рекомендуемых значений — это чревато развитием гипотензии и угнетения дыхания. Наготове должны быть наборы для интубации трахеи, проведения временной ЭКС.
Рекомендуется заранее развести в шприце 1 мг эпинефрина в 10,0 мл 0,9% натрия хлорида на случай резкого падения артериального давления — вводить по 1 мл болюсом в случае необходимости. Совет медикам: не включайте в премедикацию наркотические анальгетики и атропин.
Выполнение
2. Внутривенная анестезия, используется один из перечисленных ниже препаратов:
- 40-80 мг, препарат выбора; 5-15 мг, не очень удобен из-за длительной седации; 1% — 100-200 мг;
- Кетофол (пропофол 100 мг + кетамин 100 мг) — 3-6 мл смеси, показан при гипотензии у пациента.
Все перечисленные препараты вводить очень медленно.
Аппаратура
- Дефибриллятор с ЭКГ-монитором и наружным электрокардиостимулятором;
- Запасной дефибриллятор;
- ЭКГ-монитор с электродами;
- Гель для электродов.
Внимание. Дефибриллятор может сломаться в самый неподходящий момент, что может грозить непредсказуемыми последствиями для пациента. Запасной дефибриллятор, пусть простой конструкции, позволит избежать проблем.
Как правильно расположить электроды дефибриллятора при дефибрилляции и кардиоверсии
Стандартным расположением считается передне-боковое расположение электродов: один — справа под ключицей около грудины, второй — слева над верхушкой сердца. Но с такой же эффективностью, в зависимости от ситуации, можно использовать другие варианты расположения электродов, например передне-заднее, когда один электрод располагается около грудины слева приблизительно на уровне четвертого межреберья, а второй — напротив него со стороны спины. Или: передне-левое подлопаточное и передне-правое подлопаточное.
Если у больного имеется имплантированный кардиостимулятор или кардиовертер-дефибриллятор
При дефибрилляции, кардиоверсии у пациентов с имплантированными электрокардиостимуляторами электроды обычно устанавливают в передне-заднем или передне-боковом положении. Не стоит располагать электрод непосредственно над имплантированным устройством. Стараются выбрать такую позицию, чтобы расстояние между электродами и кардиостимулятором было > 8 см. После проведенной процедуры проводят проверку работы кардиостимулятора или кардиовертера-дефибриллятора.
Порядок проведения дефибрилляции и кардиоверсии
1. Убедитесь, что сознание у больного отсутствует. При проведении кардиоверсии с целью выключения сознания проводится кратковременная анестезия. Освободите грудную клетку от одежды.
Внимание. Перед проведением разряда отключите кислород, если больной его получал ранее.
2. Если есть запас времени, наладьте проведение мониторинга: ЭКГ, неинвазивное АД, SpO2.
3. На электрод наносят слой токопроводящего геля, следя, чтобы он равномерно покрыл электрод. Или используйте в качестве прокладки марлевые салфетки, обильно смочив их 0,9%, а еще лучше — 7-10% раствором натрия хлорида. Проследите, чтобы не был нанесен на электроды, по ошибке, Эхо-гель, предназначенный для проведения ультразвуковых исследований.
В случае использования бифазных дефибрилляторов с той же эффективностью применяют клейкие одноразовые электроды для дефибрилляторов. К тому же они, по сравнению с многоразовыми электродами, обеспечивают более стабильную ЭКГ-картинку на мониторе. В том случае, если вы пользуетесь монофазным дефибриллятором, не применяйте одноразовые электроды для дефибрилляторов, так как в этом случае эффективность дефибрилляции или кардиоверсии снижается.
4. Расположите на грудной клетке пациента электроды в соответствии с рекомендациями и согласно маркировки дефибриллятора — электрод с надписью «Apex», или электрод красного цвета (положительный), располагают над верхушкой сердца.
5. Включите дефибриллятор и задайте необходимую энергию.
6. Для включения синхронизированного режима нажмите на кнопку «SYNC» или «Синхронизировано», если планируется проведение кардиоверсии. Ни в коем случае не включайте синхронизированный режим, если планируется проведении дефибрилляции. Дефибриллятор может не сработать.
8. Убедитесь, что никто из персонала не касается больного и кровати, на которой он лежит.
9. Дайте команду «Разряд!» и нажмите на кнопку «разряд».
10. Если разряд выполнен эффективно, то у пациента непроизвольно сокращаются мышцы грудной клетки.
9. После произведенного разряда по показаниям ЭКГ-монитора оценивают, произошло ли восстановление правильно сердечного ритма. При возникновении фибрилляции желудочков, проводят немедленную дефибрилляцию. Если нарушение ритма не удается прекратить с помощью первого импульса, энергия последующих импульсов должна быть повышена, если это возможно.
Возможные причины неэффективности дефибрилляции и кардиоверсии
Используйте другой вариант расположение электродов;
- Гель на электродах отсутствует или его слишком мало (высокое сопротивление кожи):
Убедитесь, что используется подходящий для этих целей гель. Повторно смажьте электроды гелем;
- Электроды недостаточно плотно прижаты к грудной клетке:
Увеличьте мощность разряда и повторите попытку;
Проводите сердечно-легочную реанимацию и через несколько минут повторите попытку;
Рефрактерная фибрилляция желудочков:
Проводите сердечно-легочную реанимацию. В/в введите 300 мг амиодарона и 10 мл 25% магния сульфата. Повторите попытку дефибрилляции разрядом максимальной мощности.
Фибрилляция предсердий и синдром Вольфа-Паркинсона-Уайта (WPW-синдром)
При манифестации синдрома Вольфа-Паркинсона-Вайта антеградное проведение осуществляется через дополнительный путь проведения. Развитие фибрилляции предсердий является неотложным состоянием, так как могут развиться желудочковые нарушения ритма с высокой частотой сокращения желудочков.
При манифестации синдрома Вольфа-Паркинсона-Вайта (ВПВ) Синдром Вольфа — Паркинсона — Уайта (WPW) В возникновении наджелудочковых тахикардий по механизму риентри (НЖТ) участвуют электрические проводящие пути, расположенные выше бифуркации пучка Гиса. У пациентов возникают эпизоды внезапного. Прочитайте дополнительные сведения антеградное проведение осуществляется через дополнительный путь проведения. В случае возникновения фибрилляции предсердий Фибрилляция предсердий Фибрилляция предсердий — это быстрый нерегулярный предсердный ритм. Симптомы включают: перебои в работе сердца и иногда — слабость, снижение толерантности к физической нагрузке, одышку, пресинкопальные. Прочитайте дополнительные сведения (ФП) атриовентрикулярный узел (АВ) не выполняет функцию регулирования частоты предсердно-желудочкового проведения и в результате чрезмерная частота сокращения желудочков (иногда 200-300 уд./минута) может привести к фибрилляции желудочков Фибрилляция желудочков (ФЖ) Фибрилляция желудочков вызывает нескоординированное дрожание желудочков с отсутствием эффективного сокращения. Она вызывает незамедлительное синкопе и смерть в течение нескольких минут. Лечение. Прочитайте дополнительные сведения
Фибрилляция предсердий при синдроме WPW
Лечение фибрилляции предсердий и синдрома WPW
Кардиоверсия постоянным током
Терапией выбора при синдроме Вольффа-Паркинсона-Уайта является кардиоверсия постоянным током Кардиоверсия-дефибрилляция при воздействии постоянного тока (ПТ) Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится непосредственно антиаритмическая терапия. Прочитайте дополнительные сведения . Обычные препараты, применяемые для контроля ЧСС при фибрилляции предсердий, не эффективны, а дигоксин и недигидропиридиновые блокаторы кальциевых каналов (например, верапамил, дилтиазем) противопоказаны, поскольку могут вызвать повышение частоты сокращения желудочков и привести к фибрилляции желудочков. Если кардиоверсия невозможна, то следует применять препараты, увеличивающие рефрактерный период дополнительного пути. Предпочтительно внутривенное введение прокаинамида или амиодарона, но также можно использовать антиаритмические препараты Антиаритмические средства Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведения классов Ia, Ic, и III.
Здравый смысл и предостережения
Пациентам с синдромом Вольфа-Паркинсона-Уайта и фибрилляцией предсердий не следует назначать дигоксин или недигидроперидиновые блокаторы кальциевых каналов (например, верапамил, дилтиазем), так как эти препараты могут вызвать фибрилляцию желудочков.
Электроимпульсная терапия в лечении аритмии
Дефибрилляция и кардиоверсия являются видами электроимпульсной терапии. При всей своей схожести они имеют некоторые различия. Дефибрилляция — это процесс купирования фибрилляции желудочков с помощью нанесения электрического разряда, она является важнейшим реанимационным мероприятием. Кардиоверсия — способ лечения тахиаритмий, который основан на прекращении циркуляции возбуждения в миокарде путем нанесения электрического разряда в определенную фазу сердечного цикла. Кардиоверсия требует синхронизации — нанесения импульса в момент регистрации зубца R, так как в противном случае нанесение разряда в другую фазу сердечного цикла может привести к неэффективности процедуры и даже к развитию фибрилляции желудочков. Кардиоверсия бывает плановой, когда ритм восстанавливают при стабильных гемодинамических показателях при неэффективности других способов лечения, и экстренной — при пароксизмах с нестабильной гемодинамикой, при желудочковой тахикардии без пульса (в последнем случае она проводится без синхронизации и приравнивается к дефибрилляции).
Об электрических методах лечения аритмий известно еще с начала второй половины 18 века. Первый официально документированный случай применения электрических импульсов для оказания помощи при внезапной смерти относится к 1774 году, когда мистер Сквайерс (Squires), житель Лондона, попытался помочь упавшей с первого этажа трехлетней девочке, используя разряды электричества лейденских банок. На протяжении последующих нескольких дней у девочки наблюдался ступор, но приблизительно через неделю она уже была абсолютно здорова.
В последующем дефибрилляцию изучали Луиджи Гальвани, Чарльз Кайт, Джон Сноу, Жан-Луи Прево и Фредерик Бателли и другие ученые. В 1947 г. американский хирург Клод Бек провел успешную дефибрилляцию во время оперативного вмешательства на сердце у четырнадцатилетнего мальчика. Разработанный Клодом Беком дефибриллятор работал от переменного тока и позволял проводить только открытую дефибрилляцию.
Заложение научных основ для понимания ЭИТ, а также первые серьезные эксперименты в этой области были произведены Полом Золлом. Изучая кардиостимуляцию, он предположил, что применение сильного наружного электрического разряда может прерывать фибрилляцию желудочков, и уже в 1956 г. Золл совместно со своими коллегами провел первую клиническую демонстрацию успешной трансторакальной дефибрилляции. В своих исследованиях он использовал собственноручно сконструированный дефибриллятор, который генерировал переменный ток. В 1960 г. Бернард Лаун разработал свой первый дефибриллятор постоянного тока. Этот дефибриллятор стал первым в линии современных приборов подобного типа. Лауном же был предложен и метод кардиоверсии — использование синхронизированных с сердечным циклом электрических разрядов для лечения тахиаритмий.
Подготовка к плановой ЭИТ
- При длительности ФП более 48 часов и отсутствии адекватной антикоагулянтной терапии в течение последних 3 недель, перед восстановление синусового ритма с помощью ЭКВ, для исключения внутрипредсердного тромбоза необходимо предварительное проведение чреспищеводной эхокардиографии.
- Всем больным воздержаться от приема пищи в течение 6-8 ч.
- Отмена сердечных гликозидов за 3-4 дня до процедуры
- Нормализация электролитного баланса (проведение ЭИТ при гипокалиемии менее эффективно и чаще осложняется фибрилляцией желудочков)
Методы ЭИТ
Наружная ЭИТ — основной метод. Оба электрода накладывают на грудную клетку таким образом, чтобы сердце было охвачено электрическим полем разряда конденсатора. Рекомендациями ERC и AHA установлены рекомендуемые величины энергии для первого разряда при проведении дефибрилляции. Они составляют (для взрослых): при использовании монополярного импульса — 360 Дж, при использовании биполярного импульса — 120-150 Дж., у детей применяют разряды из расчёта 2 Дж/кг массы тела. При проведении дефибрилляции сейчас используется преимущественно переднее или стандартное расположение электродов, электроды обязательно смазывают специальным токопроводящим гелем, причем следует следить, чтобы он не растекался по поверхности грудной клетки между электродами. Допускается использование салфеток, смоченных физиологическим раствором. При проведении процедуры один электрод с маркировкой «Apex», или красного цвета (положительный заряд), располагают точно над верхушкой сердца или ниже левого соска; другой электрод с маркировкой «Sternum», или черного цвета (отрицательный заряд), располагают сразу под правой ключицей. Используют также переднезаднее расположение электродов — одна пластина электрода находится в правой подлопаточной области, другая спереди над левым предсердием. Существует еще и задне-правое подлопаточное расположение электродов. Выбор расположения электродов производят в зависимости от конкретной ситуации; не доказана польза или вред какого-либо из описанных расположений.
Перед проведением разряда убеждаются, что никто не прикасается к больному или к кровати, на которой он лежит. Современная контрольно-диагностическая аппаратура защищена от импульсов дефибриллятора. В момент нанесения разряда изменяются показания монитора и отмечается реакция пациента — сокращение мышц, вздрагивание, иногда вскрик. Категорически запрещается прикасаться к больному или к контактирующим с ним предметам в момент нанесения разряда, так как это опасно для персонала. После произведенного разряда оценивают показания монитора и при необходимости решают вопрос о повторном разряде.
Если пациент находится в сознании, то обязательно проведение общей анестезии. Задачи общей анестезии при кардиоверсии: обеспечить выключение сознания на короткий промежуток времени и обеспечить амнезию на период проведения манипуляции. Как правило, ограничиваются использованием короткодействующих гипнотиков в небольших дозах, вводимых внутривенно быстро (тиопентал 100-250 мг либо пропофол 50-100 мг).
Внутренняя ЭИТ — электроды прикладывают непосредственно к сердцу. При этом требуется значительно меньшая величина разряда (для взрослого пациента около 500 В или 12,5-25 Дж).
Чреспищеводная ЭИТ — один из электродов вводят в пищевод до уровня предсердий, другой располагают в прекардиальной области. Энергия разряда 12-25 Дж. Чреспищеводная ЭИТ показана при тяжело протекающих наджелудочковых тахиаритмиях, устойчивых к трансторакальным разрядам, а также для подавления тяжёлых желудочковых тахиаритмий разрядами малой энергии.
Трансвенозная внутрисердечная ЭИТ с помощью многополюсного электрода, который устанавливают в правый желудочек, применяется в палатах интенсивной терапии при рецидивирующих желудочковых тахикардиях. Энергия разряда при эндокардиальной ЭИТ варьирует от 2,5 до 40 Дж. Для купирования фибрилляции предсердий также может применять внутрисердечную ЭИТ, которая может быть двух видов: высокой и низкой энергией. При использовании высокой энергии (200-400 Дж) один электрод располагают в правом предсердии, другой на поверхности тела. Эффективность до 100%. При применении низкой энергии 2-4,5Дж один электрод располагают в правом предсердии, другой в коронарном синусе.
Осложнения кардиоверсии
ЭКВ может осложниться тромбоэмболиями и аритмиями, кроме того, могут наблюдаться осложнения общей анестезии. Частота тромбоэмболий после дефибрилляции составляет 1-2%. Ее можно снизить с помощью адекватной антикоагуляции перед плановой кардиоверсией или путем исключения тромбоза левого предсердия. Частым осложнением являются ожоги кожи. У больных с дисфункцией синусового узла, особенно у пожилых людей с органическим заболеванием сердца, может развиться длительная остановка синусового узла. Опасные аритмии, такие как желудочковая тахикардия и фибрилляция желудочков, могут наблюдаться при наличии гипокалиемии, интоксикации сердечными гликозидами или неадекватной синхронизации. Применение наркоза может сопровождаться гипоксией или гиповентиляцией, однако артериальная гипотония и отек легких встречаются редко.
Электрическая кардиоверсия у больных с имплантированными водителями ритма сердца и дефибриллятором
Понятно, что наличие подобного устройства у больного несколько изменяет технику процедуры, но отнюдь не является противопоказанием к проведению наружной дефибрилляции. Если у пациента имплантирован кардиостимулятор-кардиовертер, то следует немного изменить положение электродов. Электрод для проведения наружной кардиоверсии должен находиться на расстоянии более 6-8 см от места имплантации водителя ритма или кардиовертера-дефибриллятора. Рекомендуется передне-заднее наложение электродов. Предпочтительно использование двухфазного дефибриллятора, так как в этом случае для купирования ФП требуется разряд меньшей энергии. У пейсмейкер-зависимых пациентов необходимо учитывать возможное возрастание порога стимуляции. Такие пациенты должны находиться под тщательным наблюдением. После кардиоверсии следует проверить имплантированное устройство с помощью наружного программатора.
Рецидив аритмии после электрической кардиоверсии
Факторы, предрасполагающие к рецидивированию ФП, включают в себя возраст, длительность ФП перед кардиоверсией, число предыдущих рецидивов, увеличение размеров левого предсердия или снижение его функции, наличие ишемической болезни сердца, заболевания легких или митрального порока сердца. Предсердная экстрасистолия с изменяющимися интервалами сцепления и так называемые ранние экстрасистолы “Р” на “Т”, синусовая тахикардия, нарушения внутрипредсердной и межпредсердной проводимости, также повышают риск рецидива ФП. Антиаритмики, назначенные перед кардиоверсией, увеличивают вероятность восстановления синусового ритма и снижают риск немедленных и ранних рецидивов. Для профилактики поздних рецидивов необходим постоянный длительный прием антиаритмических препаратов. Наиболее действенным средством такой профилактики является амиодарон, превосходящий по своей эффективности все другие средства антиаритмической терапии. 69% больных сохраняют синусовый ритм в течение года применения амиодарона. Для соталола и пропафенона этот показатель составляет 39%. Некоторые пациенты, у которых эпизоды ФП, протекают с выраженной клинической симптоматикой, но возобновляются не часто (1-2 раза в год), предпочитают повторные кардиоверсии длительной противорецидивной антиаритмической терапии или лечению, направленному на снижение ЧСС в условиях сохраняющейся аритмии.
Автоматические наружные дефибрилляторы и концепция ранней дефибрилляции
Электрическая дефибрилляция сердца
Одним из самых интересных и объемных разделов кардиологии является аритмология. В рамках этой науки специалисты занимаются лечением различных нарушений ритма сердца.
Аритмии — это нарушение сердечного ритма, его частоты и регулярности сокращений, что приводит к нарушению нормальной работы сердца с неприятными субъективными ощущениями и/или, полной остановке сердца. Нормальным является синусовый ритм, все отклонения от него считаются аритмиями. Аритмия может быть самостоятельной сердечной патологией, а также возникать в виде осложнений других сердечных проблем — инфарктов, клапанной патологии сердца, миокардитов, ушибов сердца. По статистике 15% сердечных смертей обусловлены аритмиями. Самая грозная аритмия — это фибрилляция желудочков.
Ежегодно в Европейских странах фиксируется около 700 тыс случаев внезапной смерти в результате остановки сердца, из них 65% обусловлены фибрилляцией желудочков. Фибрилляция желудочков считается основным механизмом внезапной сердечной смерти.
С целью купирования фибрилляции желудочков используется метод электрической дефибрилляции. Этот метод является неотъемлемой составляющей современной интенсивной терапии. Проводится с помощью устройства дефибриллятора врачами СМП, реаниматологами реанимационных отделений. В последние годы в Европейских странах в общественных местах стали устанавливать автоматические наружные дефибриляторы (АНД). Мировой опыт применения АНД показывает существенное повышение уровня выживаемости пострадавших при ВОС: в 38% случаев внезапной остановки сердца при применении АНД случайными свидетелями, 22% — при применении прибывшими медиками, 9% — при проведении только стандартной сердечно-легочной реанимации и всего 1% — в остальных случаях.
В России сейчас рассматривается законопроект об использовании АНД. «Законопроектом предусматривается возможность оказания неограниченным кругом лиц первой помощи с использованием автоматических наружных дефибрилляторов при возникновении ситуаций, требующих оказания такой помощи», — отмечается в сопроводительных документах.
В настоящее время в России применять автоматические дефибрилляторы разрешено только определенным категориям медработников. Между тем при внезапной остановке сердца каждая минута промедления на 10% снижает шанс спасения человека,
Что же такое дефибрилля́тор — это прибор, использующийся в медицине для терапии нарушений сердечного ритма с помощью электрического импульса. Основные показания к дефибрилляции:
- фибрилляция желудочков (хаотичное сокращение со скоростью 200-300 ударов в минуту);
- трепетание желудочков (сокращение ритмичное, но со скоростью около 300 ударов в минуту);
- трепетание предсердий (ритмичное, но учащенное сокращение до 240 ударов в минуту);
- фибрилляция предсердий (хаотичное сокращение, 300 ударов в минуту).
Различают кардиоверсию и дефибрилляцию.
Кардиоверсия — воздействие электрического разряда, синхронизированное с комплексом QRS. При различных тахиаритмиях (кроме фибрилляции желудочков) воздействие электрического разряда должно быть синхронизировано с комплексом QRS, так как в случае воздействия разряда перед пиком зубца Т может возникнуть фибрилляция желудочков.
Воздействие электрического разряда без синхронизации с комплексом QRS называется дефибрилляцией. Дефибрилляция проводится при фибрилляции желудочков, когда нет необходимости или возможности в синхронизации воздействия электрического разряда. В случае успешной дефибрилляции разряд останавливает сердце, после чего оно должно восстановить собственную нормальную электрическую активность (синусовый ритм).
Электродефибрилляция (ЭДС)
Основной принцип ЭДС состоит в том, что под действием мощного и короткодействующего электрического импульса происходит деполяризация всех мышечных волокон миокарда с последующим развитием рефрактерности, после окончания которой вновь возникший импульс из синусового узла способен восстановить спонтанные сердечные сокращения.
Способы электрической дефибрилляции сердца. Различают электрическую дефибрилляцию сердца: непрямую (наружную), когда электроды дефибриллятора накладывают на грудную клетку, и прямую, когда электроды накладывают непосредственно на сердце при открытой грудной клетке.
Основа успешной ЭДС в определенной степени зависит от подготовки и знаний медицинского персонала.
В Стационарном отделении скорой медицинской помощи «Волынской больницы» УД Президента РФ персоналом отработаны навыки реанимационным мероприятий, включая и проведения дефибрилляции с использованием современного оборудования. Регулярно проводятся занятия для поддержания приобретенных навыков.
Что такое ИКД (имплантируемый кардиовертер-дефибриллятор)
Имплантируемый кардиовертер-дефибриллятор (ИКД) — представляет собой устройство, которое автоматически распознает и проводит антиаритмическую терапию большинства тахиаритмий сердца, в том числе желудочковой тахикардии (ЖТ) и фибрилляции желудочков (ФЖ).
Устройство кардиовертера-дефибриллятора ИКД
Имплантируемый дефибриллятор имеет небольшие габариты — не больше пейджера — и вживляется под кожу верхней части грудной клетки. Имплантируемый дефибриллятор состоит из металлической (титановой) коробочки, в которой находятся микросхема и батарея. ИКД стимулирует сердце когда сердце останавливается или когда сокращается неритмично или слишком медленно. ИКД также может определять электрическую активность сердца. Если кардиостимулятор определяет, что сердце сокращается самостоятельно, он не посылает электрический импульс, т.е. не стимулирует сердце.
Кроме обычных функций поддерживать сердечный ритм на определенной частоте, имплантируемый дефибриллятор следит за возникновением аномальных, неправильных ритмов. При возникновении тахиаритмий ИКД путем специальных алгоритмов стимуляции выполнит безболевое восстановление синусового ритма, или дефибрилляцию.
Имплантируемый кардиовертер-дефибриллятор (ИКД) состоит из:
• Батарея (аккумулятор), которая снабжает электрической энергией имплантируемый дефибриллятор для того, чтобы он мог стимулировать сердце (посылать электрический импульс по электроду к сердцу). Маленькая герметичная литиевая батарея служит много лет. Когда батарея истощается, имплантируемый дефибриллятор полностью заменяется.
• Микросхема -подобна маленькому компьютеру внутри кардиостимулятора. Микросхема трансформирует энергию батареи в слабые электрические импульсы, которые пациент не чувствует. Микросхема контролирует продолжительность и мощность электрической энергии, затрачиваемой для импульса.
• Коннекторный блок — прозрачный блок из пластика находится в верхней части имплантируемого дефибриллятора. Коннекторный блок служит для соединения электродов и кардиостимулятора.
Электроды
Имплантируемый дефибриллятор через вены соединяется с сердцем посредством специальных электродов. Электроды крепятся в полости правого предсердия и в полости правого желудочка. В зависисмости от вида ИКД (однокамерный, двухкамерный, трехкамерный) каждый электрод имеет свои конструктивные особенности и предназначен для стимуляции одной из камер сердца.
Электрод представляет собой специальный спиральный проводник, обладающий достаточной гибкостью, чтобы выдерживать кручение и сгибание, вызываемые движениями тела и сокращениями сердца. Электрод передает сердцу электрический импульс, вырабатываемый импульсным генератором, и несет обратно информацию об активности сердца.
Контакт электрода с сердцем осуществляется через металлическую головку на конце провода. С помощью нее стимулятор «следит» за электрической активностью сердца и посылает электрические импульсы (стимулирует) только тогда, когда они требуются сердцу.
Для лучшей фиксации электрода к миокарду были разработаны специальные электроды активной фиксации. На конце электрода находится ввинчиваемая спираль, при помощи которой электрод фиксируется к той области, которую необходимо стимулировать. Спираль выдвигается в процессе имплантации электрода и, если возникает необходимость его замены, ввинчивается в обратном направлении и такой электрод легко удаляется.
В том случае, если сердечная деятельность полностью отсутствует или ритм очень редкий, стимулятор переходит в режим постоянной стимуляции и посылает импульсы к сердцу с заданной частотой. Если будет проявляться собственный ритм сердца, стимулятор перейдет в режим ожидания, т.е. будет функционировать в режиме по требованию (on demand).
Программатор
Программатор представляет собой специальный компьютер, который используется для контроля и изменения настроек кардиостимулятора. Программатор находится в больнице. Врач использует этот специальный компьютер для того, чтобы видеть, как кардиостимулятор работает и, если необходимо, изменить настройки кардиостимулятора.
Во время контрольного осмотра или когда Вы находитесь в больнице, врач может поместить головку программатора (она очень напоминает компьютерную «мышку») над имплантированным кардиостимулятором. Это позволяет:
• Получить информацию из кардиостимулятора. Информация, полученная из кардиостимулятора, показывает как кардиостимулятор и сердце работают. На основании этой информации врач может изменять настройки кардиостимулятора.
• Изменить настройки кардиостимулятора. При необходимости врач может поменять настройки имплантированного кардиостимулятора без каких либо хирургических операций.
Какие существуют типы ИКД?
Однокамерный ИКД
Однокамерный ИКД применяется в случаях фибрилляции предсердий или когда у пациента нет преходящих блокад проведения и сердечный ритм полностью соответствует потребностям организма. Стимулятор имеет один желудочковый электрод, который размещают в полости правого желудочка. При возникновении ЖТ или ФЖ кардиостимулятор производит разряд дефибриллятора. Стимулятор имеет алгоритм сверхчастой и программированной стимуляции для предотвращения приступа ЖТ «безболевой стимуляцией». Кроме высокой эффективности алгоритма безболевой стимуляции в купировании ЖТ, данный режим практически не расходует заряд батареи ЭКС. Разряд дефибриллятора в этом случае не производится.Если у пациента брадикардия, то ИКД работает как обычный кардиостимулятор.
Двухкамерный ИКД
Двухкамерный ИКД содержит две камеры стимуляции, предназначенные для стимуляции правого предсердия и правого желудочка. Электроды размещаются в соответствующих зонах, тем самым прослеживая сердечный ритм в предсердиях и в желудочках. При АВ блокадах ИКД осуществляет кардиостимуляцию предсердного и желудочкового ритмов. Антитахикардитическая терапия осуществляется на всех уровнях, в том числе может купировать внезапное учащение предсердного ритма при трепетании предсердий, предсердной тахикардии, наджелудочковой тахикардии антитахикардитеческой стимуляцией (АТС). АТС широко применяется для осуществления безболевой терапии ЖТ, тем самым сохраняя заряд батареи ИКД.
Трехкамерный ИКД (КРТ/ИКД)
Кардиовертер-дефибриллятор с кардиоресинхронизирующей терапией. КРТ/ ИКД применяется для терапии сердечной недостаточности (СН), синхронизируя желудочки сердца в единый цикл сокращений сердца. КРТ/ИКД может осуществлять весь спектр антиаритмической терапии, в том числе осуществлять терапию разрядом дефибриллятора для восстановления сердечного ритма.
Как работает ИКД
Терапия тахиаритмий
Кардиостимулятор ИКД, постоянно «следит» за электрической активностью Вашего сердца. Он всегда может сказать какой у Вас ритм, в том числе выполнять функцию «Холтеровского монитора» записывая в память фрагменты сердечного ритма, помогая врачу узнать о ритме пациента больше, чем обычная электрокардиограмма. Если в сердце возникает тахиаритмия, то алгоритмы стимулятора проведут электрическую терапию в автоматическом режиме. Вид лечения, программа функций стимулятора зависит от параметров настройки, которые выбирает Ваш доктор. После имплантации ИКД доктор должен сообщить, какую терапию он установил.
Фибрилляция желудочков — событие, очень опасное для Вашей жизни. ИКД специально разработан, чтобы восстановить синусовый ритм шоковым разрядом. Это называется дефибрилляцией. Ваш ИКД обладает возможностью безболевого восстановления ритма (антитахикардитическая функция) и антибрадикардитической функцией лечения всех типов брадиаритмий.
Дефибрилляция
Если ИКД обнаруживает ФЖ, то он обеспечивает высокой энергией шокового разряда. Это называется дефибрилляцией. Во время дефибрилляции разряд подается непосредственно в сердце. Для восстановления синусового ритма требуется намного меньше энергии (1/10-ти) по сравнению с внешней дефибрилляцией, которую выполняют врачи в экстренных ситуациях.
Общее время от начала приступа ФЖ к разряду дефибриллятора составляет около 10 секунд. За это время происходит накопление энергии в ИКД, что необходимо для воспроизведения высокого разряда при дефибрилляции.
Кардиоверсия — восстановление ритма сердца разрядом дефибриллятора (разрядом шоковой энергии). Существует два вида электрической кардиоверсии, внешняя, путем наложения на грудную клетку специальных пластин, и внутренняя — через электрод в правом желудочке разрядом электрического тока.
Антитахикардитическая стимуляция (АТС)
Антитахикардитическая стимуляция получила широкое применение для подавления большинства тахиаритмий сердца, в том числе ЖТ. Смысл АТС заключается в определении нарушений сердечного ритма и подавлении приступа путем сверхчастой или программированной стимуляцией.
АТС широко применяется для осуществления безболевой терапии ЖТ, тем самым сохраняя заряд батареи. При неэффективности АТС или при ФЖ производит разряд дефибриллятора.
При возникновении желудочковой тахикардии ИКД выполнит проверку неправильного ритма и выполнит необходимую терапию для восстановления синусового ритма. Вид программы антитахикардитической функции определяет Ваш врач при программировании ИКД. Если установлена антитахикардитическая функция (безболевое купирование тахиаритмий), то во время приступа ЖТ стимулятор восстановит правильный ритм сердца частой, с определенной последовательностью электростимуляцией. Такая стимуляция называется антитахикардитическая терапия, при ее возникновении пациент ее не ощущает.
Антибрадикардитическая стимуляция
Если ритм сердца становится очень медленным или возникают пропуски (паузы), ИКД может работать, как работает самый простой кардиостимулятор, применяемый при брадикардиях. Камеры предсердной и желудочковой стимуляции синхронизируют верхний и нижний ритмы, тем самым создавая оптимальный вид стимуляции.
Система тревоги
ИКД может иметь встроенную функцию оповещения пациента о необходимости обращения к врачу для оценки состояния. ИКД может быть запрограммирован таким образом, что при состояниях, требующих неотложного обращения к врачу, подаются 30-секундные звуковые сигналы. Два различных тона сигнала соответствуют различным причинам. Сигналы повторяются каждые 24 часа до тех пор, пока врач не считает информацию с помощью программатора. При звуковом сигнале ИКД нужно немедленно обратиться к врачу!
Процедура имплантации ИКД
Имплантация электрокардиостимулятора — хирургическая операция, при которой выполняется небольшой разрез в правой (если Вы левша) или левой (если Вы правша) подключичной области. В зависимости от того, какой именно кардиостимулятор будет Вам имплантирован, один, два или три электрода будут введены через вену и установлены внутри сердца под контролем рентгенографии.
Как и после большинства хирургических вмешательств, после имплантации кардиостимулятора будет назначен короткий курс профилактической терапии антибиотиками и противовоспалительными препаратами.
Перед операцией лечащий врач ограничит или отменит прием некоторых лекарственных препаратов, выбор анестезии будет определен врачом анестезиологом. Операция имплантации (вшивания) стимулятора представляется простой, поскольку мало травмирует ткани, проводится в операционной, оснащенной рентгеновским аппаратом. Под ключицей пунктируется (прокалывается) вена, в нее вводится специальная пластмассовая трубка (интродьюсер), через которую в верхнюю полую вену вводятся эндокардиальные электроды. Под контролем рентгена электроды направляется в правое предсердие и правый желудочек, где и фиксируются.
Самой сложной процедурой является установка и закрепление кончика электрода в предсердии и желудочке так, чтобы получить хороший контакт. Обычно хирург делает несколько проб, все время измеряя порог возбудимости, т.е. наименьшую величину импульса (в вольтах), на которые сердце отвечает сокращением, видимым по ЭКГ. Задача состоит в том, чтобы найти наиболее чувствительное место и в то же время получить хорошую графику ЭКГ, регистрируемую с устанавливаемых электродов. После фиксации электродов они подключаются к стимулятору, который помещается в сформированное ложе под фасцией жировой клетчатки или под мышцами грудной клетки.
Разумеется, операция требует строгой стерильности и тщательной остановки кровотечения, чтобы избежать скопления крови под кожей и нагноения. Сам стимулятор и электроды поставляются в стерильном виде. В общей сложности все манипуляции занимают от одного часа до двух.
В нашей клиники с успехом выполняются операции имплантации ИКД и последующее его программирование в оптимальном режиме.
Читайте также:
- Синдром Лебера (Leber)
- Доступ и ход лапароскопической фундопликации по Toupet
- Т-клеточный пролимфоцитарный лейкоз. Диагностика т-клеточного пролиферативного лейкоза.
- КТ, МРТ при аневризме внутренней сонной артерии в вершине пирамиды
- Удаление лишних пальцев