Содержание:
- Показания и противопоказания к пункции щитовидной железы
- Подготовка и техника проведения пункции щитовидной железы
- Лабораторный этап исследования и его результаты
- Варианты заключений цитолога
Патология щитовидной железы довольно распространена, особенно, в некоторых географических зонах, а по данным статистики, к 50-летию примерно половина женского населения планеты «обзаводится» узлами в органе. С увеличением возраста растет и этот показатель, и к 70 годам узлы можно обнаружить практически у всех. Такая ситуация требует от врачей не только своевременной диагностики патологического процесса и исключения рака, но и дифференцированного подхода в отношении необходимости операции.
Пункция щитовидной железы с последующим цитологическим исследованием ее ткани считается едва ли не самым важным методом диагностики заболеваний органа. Раньше основное значение имело УЗИ, однако оно не дает абсолютной точности, возможны ошибочные выводы и, соответственно, неправильная тактика ведения, поэтому тонкоигольная биопсия под контролем УЗИ — «золотой стандарт» при обследовании больных, имеющих ту или иную патологию.
Результат пункции диктует врачу дальнейшую тактику ведения пациента — оперировать, наблюдать или лечить консервативно, ведь не зная точно, какое строение имеет образование в паренхиме органа, эндокринолог рискует ошибиться, а последствия окажутся плачевными для больного.
Многие считают, что раз назначена пункция, то впереди обязательно ждет и операция. Однако это не совсем так. Действительно, еще совсем недавно хирурги придерживались активной тактики для большинства пациентов с узлами в органе, но появление высокоинформативных способов диагностики и исключения рака позволило значительно снизить число необоснованно прооперированных.
Учитывая данные статистики относительно распространенности узлообразования в щитовидной железе и проводя всем без исключения удаление и узлов, и органа, хирурги оставили бы без щитовидной железы практически всех людей пожилого возраста. Понятно, что оправданным такой подход считать нельзя, ведь операция имеет ряд осложнений — нарушение голоса, расстройства кальциевого обмена и т. д. Кроме того, хирургия — это еще и весьма затратная сфера в системе здравоохранения, и чем больше операций проводится необоснованно, тем выше и бесполезные траты бюджетных средств.
Таким образом, пункция щитовидной железы позволяет ответить на несколько важнейших вопросов: злокачественный или доброкачественный характер несет в себе узел щитовидной железы, есть ли показания к оперативному лечению, каков должен быть его объем.
Применение пункции показало, что лишь около 5% всех узловых образований щитовидной железы являются злокачественными, остальные — «добрые», не имеющие склонности малигнизироваться. Точное определение показаний к операции снизило число прооперированных больных почти в десять раз, но среди тех, кому удалили орган, значительно возросло количество случаев рака. Это говорит о том, что операции после внедрения пункционной биопсии стали проводиться тем, кому они действительно нужны.
Роль пункционной биопсии в диагностике патологии щитовидной железы сложно переоценить. Благодаря своей информативности, метод успешно применяется во всех эндокринологических клиниках, он прост в исполнении, не требует дорогостоящего оснащения и хорошо переносится большинством пациентов.
Показания и противопоказания к пункции щитовидной железы
Если ранее считалось, что проведение пункционной биопсии показано всем пациентам с наличием узла в щитовидной железе более 1 см в диаметре, то в настоящее время показания к ее проведению многими профильными организациями во всем мире ограничиваются. Так в России с недавних пор применяется система сонографической оценки стратификации риска злокачественности узлового образования щитовидной железы EU TIRADS, согласно которой для определения показаний к проведению биопсии учитывается сонографическая структура и размеры узлового образования.
Алгоритм EU-TIRADS для стратификации риска злокачественных новообразований и принятия решения о ТАБ.
Согласно системе EU TIRADS пункционная биопсия узлов, которые являются со 100% вероятностью доброкачественными (простые кисты и губчатые (спонгиформные) узлы) можно не пунктировать.
Узлы, которые согласно системе EU-TIRADS имеют низкий риск злокачественности (EU-TIRADS-III) – 2-4% (овальные, с ровным краем, изоэхогенные/гиперэхогенные солидные узлы) подлежат пункционной биопсии при размере узла более 2 см в диаметре.
Узлы, имеющие средний (промежуточный) риск злокачественности (овальные, с ровным краем, слегка гипоэхогенные узлы) (EU-TIRADS IV) – 6-17%, необходимо пунктировать при размерах более 1,5 см в диаметре.
А вот узлы, имеющие высокий риск злокачественности (EU-TIRADS V) подлежат пункционной биопсии при размере 1 см в диаметре. К таким узлам относятся узловые образования, имеющие хотя бы один из больших признаков злокачественности:
- неправильная форма
- неровный край
- микрокальцинаты
- выраженная (по отношению к претиреоидным мышцам) гипоэхогенность
Риск злокачественности таких узлов составляет 26-87%!
Как правило, такие узлы лучше пропунктировать из 2-3 точек.
Повторная биопсия может быть показана в случае, когда первоначально доброкачественный процесс начинает вести себя подозрительно в отношении рака — появляется бугристость контуров, в паренхиме на УЗИ видны кальцинаты, а на шее прощупываются увеличенные лимфатические узлы.
Также пациенту могут назначить повторное исследование, если первая биопсия была проведена не в специализированном медицинском центре либо при исследовании были допущены ошибки, неточность в формулировках, материал оказался неинформативным и т. д.
Противопоказаний к тонкоигольной пункционной биопсии щитовидной железы практически нет. Метод считается безопасным для абсолютного большинства больных. Однако сложности могут возникнуть при обследовании детей младшего возраста, лиц с психическими отклонениями, которым может быть показан кратковременный общий наркоз на время исследования. В случае гипертонических кризов, аритмий и других сердечно-сосудистых нарушений вопрос о безопасности и времени проведения процедуры решается индивидуально.
Подготовка и техника проведения пункции щитовидной железы
Забор биопсийного материала из щитовидной железы проводится амбулаторно и занимает около четверти часа. Большая часть времени уходит на укладывание пациента, оформление документации, объяснение сути манипуляции, в то время как сам прокол и получение ткани — это считанные минуты.

Немаловажно подготовиться к процедуре и психологически, ведь излишний страх не только не оправдан, но и мешает самому пациенту объективно оценивать свое самочувствие. Возможная боль — основная причина страха. Учитывая, что укол производится в шею, он еще больше усиливается.
Многие пациенты боятся пункции и начинают паниковать заранее, думая, что это больно и крайне неприятно, а в последствии их непременно ждет операция. Однако, им можно успокоиться: применение тонких игл и, при необходимости, местных анестетиков делает пункцию почти безболезненной. Ощущения от нее сродни тем, которые все мы испытывали не раз при внутримышечных инъекциях, то есть вполне терпимы.
Другим поводом для беспокойства может стать опасение, что хирург попадет иглой не туда, куда нужно, либо спровоцирует прогрессирование патологии. Об этом не стоит беспокоиться, учитывая, что все пункции проводятся под контролем ультразвукового датчика, а после процедуры не происходит ускорения роста узлов или распространения опухоли за пределы органа.
Современные стандарты пункции щитовидной железы требует проведения процедуры только под контролем УЗИ. Дополнительная визуализация органа и объемных образований в нем повышает точность прокола до 100%, исключает взятие ткани из другого участка, позволяет сделать пункцию в наиболее измененной области узла.
Большинство больных не нуждаются в анестезии, поскольку прокол осуществляется крайне быстро, и тонкая игла практически не травмирует железу. Показания к операции зависят от результата цитологии, и необходима она далеко не каждому.
Особо чувствительным и эмоциональным субъектам может быть проведено местное обезболивание специальными кремами или спреями с анестетиком, что не снижает эффективности процедуры, но облегчает ее проведение для конкретного обследуемого.
Берут пункцию при помощи тонких игл, и чем меньше ее диаметр, тем лучше: больной меньше ощущает момент прокола, а врач получает более качественный материал, не смешанный с кровью в связи с малой травматичностью.

- Укладывание обследуемого на спину, под которую помещается валик или подушка, помогающая достичь максимального разгибания шейного отдела и облегчения доступа к железе;
- Поиск с помощью ультразвука узлового образования в паренхиме органа, уточнение его локализации и размеров, наличия дополнительных включений (кальцинаты, рубцы, кисты);
- Обработка кожи в месте прокола антисептическими средствами, ограничение зоны манипуляции стерильными салфетками;
- Введение пункционной иглы быстрым, но аккуратным движением в требуемую область под контролем УЗИ, забор материала для исследования;
- Извлечение иглы наружу и помещение полученной ткани на предметное стекло, которое после будет подвергнуто микроскопии.
Когда игла достигла узлового образования, хирург четко видит ее на экране аппарата УЗИ, продвигая в самый подозрительный участок патологического очага. По мере всасывания шприцем ткани хирург перемещает иглу в разных направлениях, стремясь изъять из органа как можно более разнообразный клеточный субстрат.
Цитологический мазок, полученный на предметном стекле, направляется на исследование к врачам-цитологам, которые помогут с определением окончательного диагноза. Заключение пациент получит в течение недели после исследования, в зависимости от сложности клинического случая и загруженности цитологической лаборатории.
Место прокола после извлечения иглы заклеивается лейкопластырем, и уже через 10-15 минут в случае хорошего самочувствия пациент может отправиться по своим делам. В день процедуры разрешается принимать душ, заниматься спортом, есть и пить в привычном режиме.
Пункция щитовидной железы считается безопасной и практически безболезненной процедурой и, вместе с тем, высокоинформативным и незаменимым этапом диагностического поиска. Осложнения при ней крайне редки, хотя исключить их полностью все же нельзя. Наиболее вероятными последствиями могут стать небольшая гематома в месте прокола кожи, что не представляет угрозы здоровью обследуемого, а также обмороки в момент забора ткани, которые более часты у эмоционально лабильных и чрезмерно боящихся исследования пациентов.
Лабораторный этап исследования и его результаты
Все пациенты, прошедшие пункцию щитовидной железы, хотят получить не только быстрый, но и максимально точный цитологический диагноз. Этого же желают и врачи, однако на деле случается иначе. Заключения могут быть не информативными, если в материале не было клеток, а содержался коллоид, если обнаружены признаки аутоиммунного тиреоидита, но ничего не сказано о характере опухолевидного образования и т. д.
Как показывает практика, вероятность получения точного цитологического ответа прямо связана с опытом хирурга, проводившего пункцию. Чем прицельнее он взял ткань для исследования, тем выше вероятность достоверного и развернутого вывода о характере патологии. Считается, что доля неинформативных ответов минимальна у специалиста, который проводит не менее 40 биопсий в неделю, а в крупных эндокринологических центрах этот показатель достигает нескольких сотен.

Когда пациент уже покинул клинику, начинается наиболее сложный и ответственный этап всей морфологической диагностики. Стекла с мазками ткани железы просушиваются и отправляются в цитологическую лабораторию, где производится их окрашивание методиками Май-Грюнвальд-Гимзы или Папаниколау. Клетки исследуются микроскопически врачом-цитологом.
Морфологические особенности пунктата — строение клеток, их размеры, включения в цитоплазме, атипия — предопределяют диагноз, который в дальнейшем будет решающим при выборе лечебной тактики.
У 9 из 10 пациентов цитолог может сформулировать предельно точный диагноз, но случается, что данных микроскопии недостаточно для исключения или подтверждения злокачественности опухолеподобного процесса (много крови в пунктате, низкая клеточность ввиду плотности узла и др.).
Причиной неинформативности могут стать не только техническая погрешность при проведении процедуры или недостаточный опыт хирурга, но и слишком разнообразный клеточный состав, когда даже очень грамотному цитологу сложно выделить преобладающий тип клеток. В этом случае специалисту ничего не остается, как констатировать неинформативность материала и порекомендовать повторную пункцию железы.
В ожидании результатов исследования, пациенты очень волнуются, ведь главная задача хирурга и цитолога — исключить злокачественную опухоль. В среднем время ожидания результата занимает около недели, хотя само приготовление препаратов и их просмотр возможны в течение одного дня.
Крупные центры, специализирующиеся на патологии щитовидной железы, выдают заключения через 1-2 дня, так как штат специалистов позволяет провести диагностику максимально быстро даже при высокой загруженности пациентами. Это позволяет минимизировать стресс у больных в ожидании ответа без ущерба качеству исследования.
Пациенту на руки выдается заключение с результатом исследования, в котором указана не только цитологическая картина (главная цель пункции), но и точные размеры и расположение узлов, их особенности по данным ультразвукового осмотра. С этим документом обследуемый направляется к своему лечащему врачу-эндокринологу для решения вопроса о дальнейшей тактике. Если показана операция, то будет назначен оптимальный для нее срок, в противном случае пациент либо будет наблюдаться, периодически проходя УЗ-контроль, либо врач выпишет консервативное медикаментозное лечение.

Для формулировки заключений цитологи всего мира используют единые международные рекомендации. Эти рекомендации требуют от специалиста максимально точного и краткого заключения, которое даст возможность хирургу или эндокринологу определить единственно верную тактику лечения.
Чтобы устранить значительную изменчивость в сообщениях о цитологических заключениях пункционной биопсии узловых образований щитовидной железы под эгидой Национального Института рака США в 2007 году были представлены согласованные рекомендации, известные как Bethesda System for Reporting Thyroid Cytopathology. Согласно системе Bethesda на основании результата цитологического исследования определяется тактика дальнейшего ведения пациента.
В России также цитологи описывают полученный при пункционной биопсии результат согласно этой системе.
Система цитологических заключений щитовидной железы Bethesda: категории диагностики и риск злокачественности
| Диагностическая категория | Расчетный/
прогнозируемый риск злокачественности |
|
| Bethesda I | Недиагностический / неудовлетворительный Nondiagnostic or unsatisfactory | 1–4 % |
| Bethesda II | Доброкачественный
Benign |
0–3 % |
| Bethesda III | Атипия неопределенного значения / фолликулярное поражение неопределенного значения
Atypia of undetermined significance or follicular lesion of undetermined significance (AUS / FLUS) |
5–15 % |
| Bethesda IV | Фолликулярное новообразование / подозрительное на фолликулярное новообразование
Follicular neoplasm or suspicious for a follicular neoplasm (FN / SFN) |
15–30 % |
| Bethesda V | Подозрительные на злокачественность
Suspicious for malignancy (SUSP) |
60–75 % |
| Bethesda VI | Злокачественная опухоль
Malignan |
97–99 % |
Рекомендации по использованию системы Bethesda Российской ассоциации эндокринологов (2016)
| — неинформативная пункция – вероятность злокачественности – 1 – 4%, рекомендуется повторная ТАБ; |
— доброкачественное образование – вероятность злокачественности – 0 – 4%, рекомендуется динамическое наблюдение. Показания к оперативному лечению при доброкачественном заключении ТАБ:
|
| — атипия неопределенного значения – вероятность злокачественности – 5 – 15%, рекомендуется повторная ТАБ; |
| —атипия неопределенного значения повторно – вероятность злокачественности – 20 –40%, рекомендуется гемитиреоидэктомия с интраоперационным гистологическим исследованием; |
| — фолликулярная неоплазия – вероятность злокачественности – 15 – 30%, рекомендуется гемитиреоидэктомия с интраоперационным гистологическим исследованием; |
| — фолликулярная неоплазия более 5 см – вероятность злокачественности более 50%, в связи с низкой чувствительностью интраоперационного гистологического исследования и высокой вероятностью повторной операции, возможно обсуждение с пациентом целесообразности выполнения тиреоидэктомии; |
| — подозрение на злокачественную опухоль – вероятность злокачественности – 60 – 75%, рекомендуется тиреоидэктомия; |
| — злокачественная опухоль – вероятность злокачественности – 97 – 99%, рекомендуется тиреоидэктомия. |
Рекомендации по использованию системы Bethesda Американской тиреоидологической ассоциации (American Thyroid Association — ATA) (2015)
| Диагностическая категория | Риск злокач. | Тактика |
| Bethesda I | 1-4% | Следует повторить ТАБ, — если возможно с цитологической оценкой на месте.
Если повторная ТАБ недиагностическая, узлы без сонографической картины высокого риска злокачественности требуют тщательного наблюдения. Хирургическое вмешательство следует рассматривать если узел имеет сонографическую картину высокого риска злокачественности, рост узла (> 20% в двух измерениях) или при наличии клинических факторы риска для злокачественного образования. |
| Bethesda II | 0-3% | Узлы с сонографической картиной высокого риска злокачественности – повторить УЗИ и ТАБ в течение 12 месяцев.
Узлы с сонографической картиной низкого и среднего риска злокачественности — повторить УЗИ через 12–24 месяца. Узлы с сонографической картиной очень низкого злокачественности (включая губчатые узлы) -наблюдение. Повторное УЗИ не ранее чем через 24 месяца. Если при повторной ТАБ получен доброкачественный результат наблюдение за узлами для подтверждения риска злокачественности не требуется. |
| Bethesda III | 5-15% | Для узлов с сонографической картиной высокого риска злокачественности – повторная ТАБ или молекулярное тестирование.
Если повторное цитологическое исследование, молекулярное тестирование или и то и другое не выполняются или не дают результатов, может быть выбрано либо наблюдение, либо диагностическая гемитиреоидэктомия в зависимости от клинических факторов риска, сонографических признаков или желания пациента. |
| Bethesda IV | 15-30% | Диагностическое хирургическое иссечение узла ЩЖ – гемитиреоидэктомия.
Тем не менее, возможно отложить оперативное лечение после рассмотрения клинических и сонографических особенностей узла, молекулярного тестирования. Информирование пациента и его мнение должны учитываться для принятия решения. Если нет возможности провести молекулярное тестирование, хирургическое удаление ЩЖ может быть рассмотрено для установления окончательного диагноза. |
| Bethesda V | 60-75% | Хирургическое лечение. Объем операции зависит от клинических факторов риска, сонографических особенностей, предпочтений пациента и, возможно, результатов мутационного тестирования (если оно проводилось).
Предпочтительный объем операции — тиреоидэктомия После рассмотрения клинических и сонографических особенностей мутационное тестирование на BRAF или панель маркеров мутации из семи генов ( BRAF , RAS , RET / PTC , PAX8 / PPARγ ) может быть рассмотрено в узлах с данным цитологическим заключением, если эти данные могут повлиять на принятие клинического решения и выбора объема операции. |
| Bethesda VI | 97-99% | Тиреоидэктомия |
Рекомендации по использованию системы Bethesda Корейской радиологической ассоциацией (Korean Society of Thyroid Radiology (KSThR) (2016)
| Результат ТАБ | Сонографические признаки узла K-TIRADS | Тактика |
| Bethesda-1 | Высокие подозрения
Средний или низкий уровень подозрений |
Повторная ТАБ в течение 3–6 месяцев
Повторная ТАБ в течение 6–12 месяцев |
| Bethesda-2 | Высокие подозрения
Средний или низкий уровень подозрений |
Повторная ТАБ в течение 6–12 месяцев
УЗИ через 12–24 месяца |
| Bethesda-3 | Высокие подозрения
Средний или низкий уровень подозрений. |
Повторная ТАБ в течение 3–6 месяцев
Повторная ТАБ в течение 6–12 месяцев. |
| Bethesda-4 | Все узлы | Диагностическая операция (гемитиреоидэктомия) |
| Bethesda-5 | Высокое или среднее подозрение
Низкое подозрение |
Хирургическое лечение
Повторная ТАБ или оперативное лечение. Активное наблюдение вместо немедленной операции может рассматриваться у взрослых пациентов с вероятной или доказанной папиллярной микрокарциномой |
| Bethesda-6 | Все узлы | Хирургическое лечение.
Активное наблюдение вместо немедленной операции может рассматриваться у взрослых пациентов с вероятной или доказанной папиллярной микрокарциномой |
Представленные рекомендации имеют некоторые отличия, но все они сводятся к тому, что при неинформативном или неопределенном результате необходимо повторить исследование. Если результат пункции не соответствует сонографической картине узла, то пункцию также следует повторить.
Необходимость и сроки повторной пункции должен определить ваш лечащий врач
Биопсия — самый «близкий к телу» метод диагностики. От пациента отщипывают кусочек и изучают под микроскопом. В воображении некоторых пациентов биопсия приравнивается чуть ли не к хирургической операции. Это не так, хотя и то, и другое может проводиться одновременно. Что же такое биопсия, какая она бывает и для чего проводится, рассказывает MedAboutMe.
Что такое биопсия в медицине?
Биопсия — это метод анализа тканей человеческого организма. Суть его очень проста: взять образец органа (биоптат), извлечь его из организма и внимательно рассмотреть. Собственно, сам термин это и означает в переводе с греческого: bios — живой и opsis — наблюдение при помощи глаз, то есть, визуальное исследование живой ткани.
История биопсии начинается с имени арабского врача Альбукасиса, которого называют мусульманским отцом хирургии — он же Абу аль-Касим Аль-Захрави. Именно он впервые использовал полую иглу, чтобы получить образец тканей зоба щитовидной железы и впоследствии исследовать его. Долгое время врачи делали биопсию, скорее, случайно, чем намеренно. Но в конце XIX века все изменилось. Технологии исследования тканей при помощи микроскопа и возможности взятия образцов развились достаточно — и медицина получила новый метод.
В России первую диагностику при помощи биопсии провел в 1875 году доктор М.М. Руднев. В 1878 году немецкие ученые описали исследование образца шейки матки. А в 1879 году парижский дерматолог Эрнест Анри Бенье, который проводил научные изыскания в области болезней кожи, ввел термин «биопсия», обозначив им процедуру взятия образцов тканей.
Следует понимать, что биопсия — это инвазивный метод, то есть, при этом совершается проникновение в тело человека. И это травматичный метод, приводящий хоть и к минимальным, но повреждениям тканей. Поэтому врачи назначают биопсию тогда, когда без нее не обойтись. Просто так данный метод никогда не используется.
Итак, биопсия позволяет получить образец клеток или тканей. Его можно изучать на клеточном уровне, то есть, исследуется состояние отдельных клеток и их компонентов — цитологическое исследование, для которого может использоваться световой или более мощный, электронный микроскоп. А можно при помощи светового микроскопа анализировать срез ткани — при многих заболеваниях изменения происходят в структуре ткани органа. Иногда при проведении гистологического анализа требуется предварительная обработка образцов специальными растворами — их окрашивание или иная подготовка для диагностики.
В зависимости от того, какой метод предполагается использовать, биопсия проводится разными путями.
Как получить образец для исследования при биопсии?
Для цитологического исследования образцы материала получают одним из следующих методов:
- Соскоб (мазок) — с пораженных тканей специальным шпателем или скальпелем на предметное стекло соскребается некоторое количество материала.
- Тонкоигольная биопсия — клетки органа или жидкость забираются путем отсасывания через полую длинную тонкую иглу. Так получают образцы костного мозга или кист.
При заборе кусочка тканей, в зависимости от того, какие ткани и каким образом надо исследовать, выделяют два вида биопсии:
- Эксцизионная — при этом удаляется и направляется на исследование все образование, а не отдельная его часть. Например, это может быть подозрительная родинка. В этом случае биопсия является одновременно и лечебной, и диагностической процедурой: сначала подозрительные ткани полностью удаляют, а потом проверяют: насколько они были опасны и не стоит ли поискать другие проявления болезни.
- Инцизионная — на исследование забирается только часть пораженной болезнью ткани.
Забор тканей может проводиться разными путями:
- Пункционная биопсия — образец тканей забирается при помощи полой иглы. Обычно используется для получения образца тканей, расположенных недалеко от поверхности кожи.
- Трепан-биопсия позволяет получать образец ткани в виде столбика при помощи трепана — специальной полой трубки. Используется при необходимости получения образца из плотных опухолей и костей.
- Кор-биопсия (режущая, сердцевинная биопсия) — разновидность трепан-биопсии, отличающаяся от нее механическими особенностями трепана. Проводится при помощи биопсийного пистолета — устройства для получения образцов молочной и щитовидной желез, почек, простаты, печени и других мягких тканей.
- Петлевая биопсия — при этом образец забирается при использовании петли и устройства, позволяющего резать ткань (коагулятор или радиочастотный аппарат). Проводят при эндоскопических исследованиях, а также при гинекологическом обследовании и др.
- Щипковая биопсия (панч-биопсия) — образец ткани удается получить при помощи специальных щипцов. Чаще всего используется при заболеваниях пищевод, желудка и кишечника.
- Скарификационная биопсия проводится устройством, позволяющим срезать тонкий слой ткани. Обычно используется при необходимости проведения биопсии кожи.
Самый частый побочный эффект биопсии — боль при проведении процедуры. Поэтому в большинстве случаев предварительно проводится местная анестезия — обезболивание конкретного участка, на котором будет проводиться забор тканей. Но, если речь идет только о соскобе, то, конечно, анестезия не нужна.
Биопсия не проводится при нарушениях свертываемости крови, а также при возможности получить требуемые данные другими, неинвазивными методами диагностики.
Биопсия и диагностика заболеваний
Устоялось мнение, что биопсия проводится, прежде всего, для опровержения или подтверждения предварительного диагноза «рак». И действительно, этот метод обязателен для окончательной постановки диагноза онкологами. Но он также успешно применяется и в других направлениях медицины, а не только в онкологии.
- Урологи исследуют ткани мочеполовой и мочевыделительных систем для поиска воспалительных процессов почек и мочевого пузыря, а также кистозных образований в них;
- Гинекологи при помощи биопсии диагностируют бесплодие, воспаление, предраковые состояния, а также некоторые эндокринные болезни;
- Гастроэнтерологи анализируют состояние желудочно-кишечного тракта: выявляют участки воспаления и ткани в предраковом состоянии и др.;
- Пункция лимфатических узлов проводится для их оценки при аутоиммунных, инфекционных и онкологических заболеваниях.
- Биопсия пересаженных органов необходима, чтобы проверить, не идет ли реакция отторжения.
- Пункция спермы может проводиться для оценки фертильности в ходе лечения бесплодия.
А в феврале этого года американские ученые сообщили, что разработали метод ранней диагностики болезни Паркинсона путем биопсии тканей подчелюстной слюнной железы. Метод позволяет выявить белок, указывающий на наличие болезни, на стадии, когда нет даже первых признаков заболевания. Это значит, что можно будет раньше начать лечение.
Обычно биопсия назначается, когда нет других возможностей получить информацию о клетках и тканях пораженного органа. Причем нередко забор тканей проводится «заодно» — раз уж все равно добрались до больного органа, почему бы не отщипнуть кусочек для анализа. То есть, взять образец тканей можно в процессе хирургической операции или других диагностических процедур, таких как:
- эндоскопия,
- колоноскопия,
- бронхоскопия и др.
Для проведения биопсии врач может воспользоваться дополнительным оборудованием, позволяющим наблюдать за процедурой, чтобы «не промахнуться» — томографом, аппаратом УЗИ или иной аппаратурой.
Ошибки при проведении биопсии
Идеальных методов диагностики медицина не знает. При проведении биопсии тоже возможны ошибки и получение ложноотрицательного результата, то есть, болезнь есть, но ее не нашли. Так, считается, что гистологическое исследование тканей — довольно точный метод и достоверен на 90%. Что может быть причиной ошибок при биопсии:
- при заборе было получено слишком мало материала и его оказалось недостаточно для полноценной диагностики;
- забор материала для анализа произведен не из опухоли, а из здоровых тканей рядом с ней;
- материал взят из зоны фиброза или некроза опухоли и не дает достаточно информации, чтобы определить наличие злокачественного образования;
- при подготовке материала к исследованию срез был проведен под неудачным углом;
- врач-морфолог не обладал достаточным опытом для выявления характерных признаков на сложном образце.
Выводы
- Биопсия — инвазивный, но малотравматичный метод диагностики, который никогда не назначается врачом просто так, без достаточных на то оснований. Если врач считает, что нужна биопсия — лучше не спорить, часто вовремя проведенный анализ является залогом жизни пациента.
- Современные технологии позволяют провести биопсию качественно и практически безболезненно.
- Результаты биопсии считаются окончательными. По ним врач может назначать лечение. Если результаты вызывают сомнения у врача (например, по всем признакам есть опухоль, а биопсия ее не показала) — возможна ошибка при заборе пробы. В этом случае врач может направить пациента на повторный анализ.
- Если результаты биопсии вызывают сомнения у пациента, он может забрать свои «стекла» с гистологическими срезами и отправить их на повторный анализ в другую клинику.
Клиническая лабораторная диагностика: национальное руководство / Под ред. В. В. Долгова, В. В. Меньшикова. – 2012
Руководство по лабораторным методам диагностики / Кишкун А.А. – 2013
Диагностика заболеваний редко обходится без инструментальных и лабораторных исследований. Оценки симптомов недостаточно — нужно узнать, что происходит внутри органов и тканей. Одним из наиболее точных методов обследования является биопсия. Врач производит забор тканевого материала в области предполагаемого патологического процесса с целью его дальнейшего изучения. Микроскопический анализ полученного образца помогает выявить характерные для определенного заболевания изменения. В онкологической практике биопсия считается информативным методом уточнения типа опухоли, ее стадирования.
- Что это за анализ?
- Показания к проведению
- Виды и способы проведения биопсии
- Подготовка
- Может ли биопсия быть ошибочной?
Что это за анализ?
Биопсия — высокоинформативный способ обследования, применяемый в случае необходимости анализа клеток в определенной анатомической области. Забор тканей с их последующим обследованием с помощью микроскопии дает возможность точно оценить клеточный состав. Без такой процедуры сложно обойтись, если врач подозревает наличие доброкачественного или злокачественного новообразования в определенном органе. Это уточняющее исследование, дополняющее результаты других диагностических процедур. Онколог анализирует результаты биопсии, рентгенографии, эндоскопии и иммунологических тестов совместно.
Онкологические заболевания развиваются быстро и угрожают жизни пациента. Нужно как можно раньше выбрать наиболее эффективную схему лечения. Именно с этой целью проводится биопсия. По результатам процедуры врач приходит к выводу, какие травматичные или даже опасные с точки зрения осложнений способы лечения уместны в данном случае. Подбирается тактика оперативного вмешательства, радиотерапии, химиотерапевтического лечения. Все это было бы невозможно без точного определения типа опухоли, ее стадии и распространенности в организме. Нужны цитологические и гистологические тесты.
В качестве примера можно привести злокачественное новообразование прямой кишки, растущее в нижней части органа. В качестве основного метода лечения выполняется иссечение этой анатомической структуры с последующим формированием колостомы для выделения каловых масс. Если диагноз не был полностью подтвержден, подобное вмешательство не проводят. Оно может по ошибке сделать пациента инвалидом.
Показания к проведению
Подобная диагностическая процедура требуется, если врач предполагает о наличии патологического процесса, подтверждение которого невозможно с помощью других способов исследования. В большинстве случаев это онкологические болезни, однако область применения биопсии ими не ограничивается. Например, такое исследование часто назначают гастроэнтерологи для оценки состояния слизистой оболочки органов пищеварительного тракта. Определяется вид воспалительного процесса, подбирается способ его лечения. В гинекологии и эндокринологии этот метод дает возможность определить причину нарушения фертильности, обнаружить ранние признаки воспаления и дисплазии.
Также биопсия необходима для определения особенностей течения и степени тяжести патологического процесса при болезнях печеночной ткани, почек, головного мозга, мышц и других анатомических структур. Это важно для подбора и изменения схемы медикаментозной терапии. По результатам анализа врач определяет прогностические данные.
Виды и способы проведения биопсии
В современной клинической практике чаще всего используют следующие методики выполнения биопсии:
- Мазки, соскобы и бритвенный метод. Зачастую специалисту требуется небольшое количество материала для постановки диагноза. Можно выполнить мазок и получить все необходимые данные при его последующей микроскопии. Например, такой способ часто применяют в гинекологии. Бритвенная биопсия предполагает иссечение тонкого участка кожного покрова с помощью скальпеля или другого инструмента.
- Тонкоигольная пункция. Такая процедура тоже подходит для случаев, когда достаточно получить немного клеток. В область предполагаемого патологического процесса вводится тонкая игла, захватывающая тканевой образец.
- Толстоигольная пункция. Позволяет произвести забор большого образца тканей без иссечения. Ее назначают при злокачественном новообразовании молочной железы, печеночной ткани, предстательной железы. Трепан-биопсия подходит для исследования кожного покрова, костномозговых структур. Используется специальный инструмент в форме цилиндра.
- Аспирационный метод. Это современная техника забора материала, при котором используется вакуумный прибор в форме цилиндра. В качестве механизма применяется отрицательное давление. Прибор присоединяют к игле. Аспирация дает возможность взять несколько образцов в разных участках анатомической структуры.
- Операционная биопсия. Проводится непосредственно во время операции, когда врач иссекает опухолевую ткань. Это высокоинформативное исследование, позволяющее оценить состояние большого количества тканей. Минус такого вида процедуры — определить тип болезни можно только после операции. Плюсом можно считать совмещение лечебной практики с достоверной диагностикой.
- Эндоскопическая биопсия. Проводится во время диагностики внутренних полостных структур, вроде пищеварительного или респираторного тракта. С помощью эндоскопа врач осматривает подозрительные участки тканей и выбирает место забора материала. Плюсом такой техники можно считать повышенную точность результатов исследования.
Способ проведения диагностики выбирают в зависимости от анамнеза пациента.
Подготовка
В большинстве случаев специально готовиться не следует. Достаточно прийти к врачу в день проведения процедуры и подписать необходимые документы. Специалист объяснит, как будет проходить обследование. Расскажет о рисках и возможных неприятных ощущениях. Определенные виды биопсии выполняют под местным обезболиванием. Реже требуется наркоз. Пациент может сам выбирать комфортный для него способ выполнения диагностики. В случае наркоза нужны специальные подготовительные процедуры.
Для биопсии характерны стандартные осложнения, возникающие при других видах вмешательств. Возможно кровоизлияние, инфицирование тканей. Реже возникает травматизация внутренних органов. Такие негативные последствия редки, но врач обязательно уведомляет пациента о рисках.
Может ли биопсия быть ошибочной?
Достоверность исследования зависит от способа его проведения, анамнеза пациента, опыта врача и других факторов. Например, при пункции специалист может получить образец тканей без злокачественных клеток, если игла попала в соседнюю с опухолью область. В этом случае возможен ложноположительный результат. Онкологи учитывают такую вероятность, и всегда назначают уточняющие исследования. Диагноз не ставится только на основе результатов одной процедуры. Всегда проводится комплексная оценка состояния организма.
Статья на конкурс «био/мол/текст»: Рак — та проблема, которая так или иначе волнует каждого из нас, а некоторых, к сожалению, коснулась напрямую. Сегодня заболеваемость онкологическими патологиями неуклонно растет. Однако сейчас мы бы хотели поговорить с вами о том виде рака, который бояться в большинстве случаев совсем не нужно! Это рак щитовидной железы. Заинтригованы? Читайте эту статью.
Несомненно, XXI век — время развития научно-технического прогресса. Вместе с совершенствованием технологий приходит и их доступность в повсеместном использовании. Медицина не является исключением. Благодаря развитию технологий диагностики и лечения самых разных заболеваний мы стали спасать тех пациентов, которые когда-то входили в число неизлечимых. Однако не на все сферы медицины прогресс повлиял так положительно. Поэтому сегодня мы бы хотели познакомить вас с такими животрепещущими вопросами медицины, как гипердиагностика и гиперлечение. Сейчас мы остановимся лишь на одной, но весьма значимой стороне данной проблемы — гипердиагностика узлов щитовидной железы, а также гиперлечение этих узлов и рака щитовидной железы.
Что мы знаем сегодня про узлы щитовидной железы?
26 сентября 2019 года в группе «Медфронт» во «ВКонтакте» появилась небольшая статья Александра Циберкина, врача-эндокринолога, создателя блога «Занимательная эндокринология» [1]. Проблема, которая поднималась в статье, достаточно проста: многим из нас когда-то предлагали сделать УЗИ щитовидной железы на всякий случай. На наш взгляд, Александр рассказывает о проблеме гипердиагностики и гиперлечения для того, чтобы врачи всерьез задумались, правильно ли назначать не всегда нужные анализы всем, и насколько серьезной проблемой является обнаружение узла в щитовидной железе в процессе такого скрининга.
Однако то, что эта проблема была озвучена совсем недавно, не значит, что о ней больше не надо писать. Мы не хотим загружать вас медицинской терминологией, вновь писать о TI-RADS и разбирать по кусочкам, что может написать функциональный диагност в заключении. Мы обращаемся к вам в качестве потенциальных пациентов и хотим донести мысль, что не всегда узел в щитовидной железе опасен, а рак априори смертелен.
База, с которой нам нужно познакомиться: щитовидная железа
Немножко о щитовидной железе (ЩЖ). Это орган эндокринной системы человека, который располагается на передней поверхности шеи в области гортани, прямо перед щитовидным хрящом. Состоит железа из левой и правой долей и перешейка. ЩЖ богато кровоснабжается разными артериями, а иннервируется гортанными нервами.
Главной функцией щитовидной железы (лат. glandula thyroidea) является синтез тиреоидных гормонов, необходимых нашему организму. Под тиреоидными гормонами мы подразумеваем два соединения: тироксин (Т4) и трийодтиронин (Т3). Основной функцией Т4 и Т3 является увеличение потребления клетками кислорода. Иначе говоря, эти гормоны стимулируют все энергетические процессы в клетке и обмен веществ, причем их влияние распространяется на все клетки организма.
Также клетки ЩЖ производят кальцитонин, ответственный за обмен кальция в организме.
Прямо за щитовидной железой располагаются четыре небольшие паращитовидные железы. Последние производят паратиреоидный гормон, который также отвечает за поддержание уровня кальция в организме, причем в большей степени, чем кальцитонин.
Откуда берется столько случаев рака щитовидки?
Рак щитовидной железы (РЩЖ) — наиболее распространенное злокачественное новообразование эндокринной системы [2]. Все чаще мы слышим, что заболеваемость РЩЖ неуклонно растет. И звучит это ужасающе, однако так ли всё просто на самом деле? Возможно, вы будете шокированы, какая правда скрывается за этими, на первый взгляд, однозначными научными фактами. И прежде, чем мы разберемся с истинной причиной роста заболеваемости РЩЖ, необходимо ознакомиться с тем, какие виды рака щитовидки существуют.
Итак, начнем. Сейчас нам понадобится привести немного численных данных, но не пугайтесь их, всё крайне просто. В научном сообществе выделяют пять типов РЩЖ:
- Папиллярный (80–85% случаев).
- Фолликулярный (10–15% случаев).
- Медуллярный (5% случаев).
- Низкодифференцированный (1% случаев).
- Недифференцированный (0,1–0,2% случаев).
Наиболее благоприятными принято считать два первых типа РЩЖ. И как мы можем заметить, они встречаются наиболее часто. Их также называют высокодифференцированными типами рака. Медуллярный, низкодифференцированный и недифференцированный типы считаются агрессивными формами РЩЖ. В нашей статье мы сделаем акцент лишь на первых двух типах РЩЖ, так как они являются наиболее распространенными.
Что означает понятие «дифференцировка»?
Когда-то давно, еще до нашего рождения, каждый из нас представлял собой одну-единственную клетку. Во время внутриутробного развития клеток стало в триллионы раз больше! И каждая из них обрела свою собственную функцию: одни отвечают за биение нашего сердца, другие защищают наш организм от внешних и внутренних опасностей, а третьи отвечают за когнитивные функции. И таких видов клеток более 230! Путь, который проходит клетка от той единственной, стоявшей в начале нашего пути, до высоко специализированной клетки, у которой есть четкие обязанности, и называется «дифференцировка».
Что касается рака — если клетки, из которых состоит опухоль, являются высокодифференцированными, в большинстве случаев врачи считают исход благоприятным. Однако если опухоль состоит из низкодифференцированных клеток, то с большой вероятностью она склонна к агрессивному течению. Как уже было сказано, наиболее часто выявляемые РЩЖ являются высокодифференцированными.
Папиллярный РЩЖ — наиболее распространенная форма: 80–85%. И с самым хорошим прогнозом. Пятилетняя выживаемость пациентов с РЩЖ — 98,1% [2]. Что это значит для пациента? Что наиболее часто выявляемые случаи РЩЖ имеют благоприятный исход!
Рак, ушедший в себя
Наше традиционное понимание РЩЖ, а именно его развития, в корне изменилось благодаря трем исследованиям 2014 года (Thyroid cancer trilogy) [3–5]. Казалось бы, все злокачественные образования по мере развития подвергаются прогрессии, а потому нуждаются в ранней диагностике и оперативном лечении. Впервые за всю историю человека было обнаружено существование «самоограничивающихся раков» (self-limiting cancers), которые являются злокачественными, но при этом не прогрессируют в летальные формы из-за ограниченной способности к делению клеток, составляющих опухоль. Конечно же, существуют и так называемые летальные РЩЖ (lethal thyroid cancers). Различие между ними заключается в происхождении раковых клеток, что и определяет развитие заболевания и его исход. Во втором случае клетки как бы затаиваются на долгий срок, на годы и даже на десятилетия, а потом по невыясненным еще причинам внезапно начинают делиться и приводят к неблагоприятному исходу. Однако на данный момент считается, что именно «самоограничивающиеся» типы РЩЖ составляют большинство.
Подбираемся к корню проблемы: статистика и диагностика
Вернемся к распространенности РЩЖ. Теперь мы готовы понять, что возросшее число случаев данной патологии не является поводом для беспокойства.
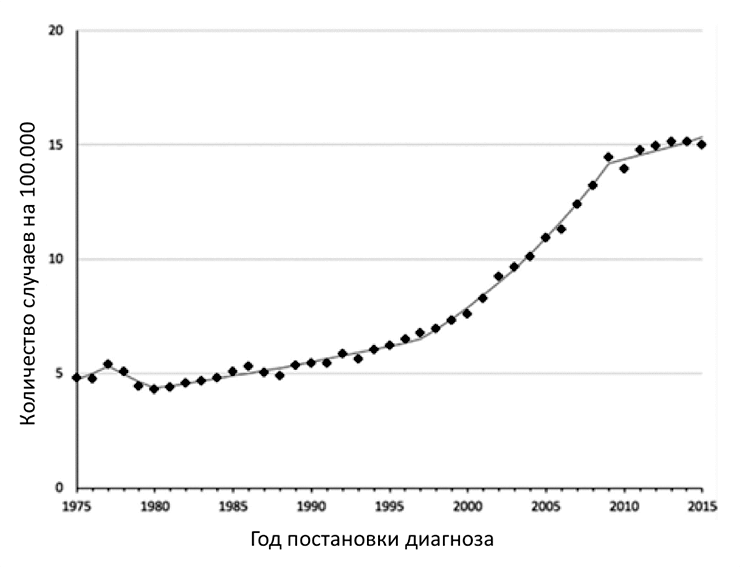
В 1975 году заболеваемость РЩЖ составляла 4,9 на 100 000 человек и оставалась относительно стабильной до начала 1990-х годов [6]. За последние 25 лет заболеваемость РЩЖ выросла более чем в 3 раза, то есть на 300% (рис. 1) [7], [8], причем в большинстве случаев за счет высокодифференцированного папиллярного РЩЖ. При этом очень важно понимать, что, несмотря на такой значительный рост, смертность от РЩЖ остается стабильной, примерно 0,5 случаев на 100 000 человек [6].
Рисунок 1. Данные заболеваемости раком щитовидной железы в период с 1975 по 2015 годы
Чувствуете, что тут что-то не так? Нет связи между возросшим числом случаев РЩЖ и смертностью от этой патологии! Среди врачей и ученых до сих пор продолжаются дебаты, почему так происходит. Сейчас выделяют несколько теорий. Наиболее вероятная — широкое распространение методов ультразвуковой диагностики (УЗИ). Пусть корни УЗИ уходят к Леонардо да Винчи и XV веку, широкое медицинское распространение данный метод получил с 50-х годов XX века [9], [10]. Сегодня УЗИ является наиболее простым, дешевым, неинвазивным и информативным методом выявления опухолевых образований щитовидной железы. Поэтому, как вы можете догадаться, УЗИ стали делать почти всем, причем независимо от показаний.
Сейчас научное сообщество активно дискутирует на тему, связаны ли такие показатели с истинным увеличением заболеваемости РЩЖ, или же проблема в гипердиагностике тех небольших образований ЩЖ, которые не требуют никакого вмешательства со стороны человека [11], [12].
Для более полного понимания проблемы вернемся на чуть более ранний этап диагностики РЩЖ.
Что такое узлы и как их найти?
Узлы ЩЖ — это радиологически различимые объемные образования в ЩЖ, которые могут быть доброкачественными и злокачественными. Узлы можно найти в 50% случаев всех проводимых УЗИ ЩЖ. При этом только 5% выявляемых образований будут злокачественными [13], [14].
Весомый вклад УЗИ в возросшее количество диагностированных узлов и РЩЖ можно показать на примере одного нашумевшего исследования в Южной Корее [3], [15], [16]. В 1999 году там была утверждена национальная программа, направленная на скрининг злокачественных заболеваний. Под программу попала и щитовидная железы. В результате повсеместного внедрения УЗИ щитовидки частота выявления рака выросла в 15 (!) раз с 1993 по 2011 год. И это мы еще не говорим просто об узлах, которые также могут быть психологической проблемой пациента. Большинство выявляемых случаев — папиллярный РЩЖ. Как вы помните, этот вид рака имеет весьма благоприятный исход. Однако простому населению идея жить с раком настолько чужда и неприятна, что было проведено огромное число полного удаления щитовидных желез, причем часто без видимой на то необходимости! А такая операция имеет серьезные последствия, о которых мы расскажем чуть ниже.
Врачи, осознав свою ошибку, убрали УЗИ щитовидки из списка обязательных скрининговых тестов. И результат не заставил себя ждать. В последней на эту тему публикации 2015 года сказано, что на 30% снизилась заболеваемость РЩЖ, а число операций на щитовидной железе снижалось на 35% ежегодно. Вывод напрашивается сам собой: в основе увеличения числа диагностированных случаев узлов щитовидки (в том числе и РЩЖ) является ставшее таким доступным УЗИ.
Думаем, следует также сказать, что образования ЩЖ выявляются не только при выполнении УЗИ, но и при использовании других методов лучевой диагностики (КТ, МРТ, ПЭТ), что стало возможным благодаря улучшению разрешающей способности оборудования. Следовательно, увеличилось чисто случайно выявляемых образований щитовидной железы (в том числе, рака) — инциденталóм (от англ. incidence — случайность) [17]. Инциденталомы клинически никак себя не проявляют и могут оставаться в организме бессимптомно всю жизнь. И многие из таких инциденталом обнаруживались лишь посмертно, случайно, и не являлись причиной кончины человека. Это позволяет говорить нам о существовании резервуара пациентов с узлами или раком щитовидной железы, который клинически является скрытым и никак себя не проявляет до его случайного обнаружения [18].
Приведенные данные обобщены на рисунке 2.
Рисунок 2. Что даст нам УЗИ щитовидки на самом деле?
рисунок авторов статьи
Напомним, что в нашей статье мы делаем акцент на наиболее распространенных типах РЩЖ (папиллярный, фолликулярный). Агрессивные формы РЩЖ (медуллярный, низкодифференцированный, недифференцированный и редко папиллярный) требуют дальнейшего более детального изучения
Самое главное: почему гипердиагностика и гиперлечение РЩЖ являются проблемой?
Является ли столь чрезмерное выявление объемных образований ЩЖ проблемой? Да, и очень даже серьезной. И она получила свое название — гипердиагностика (overdiagnosis) [19], [20]. И проблема состоит в том, что следствием ее становится гиперлечение. На самом деле она касается не только ЩЖ и представляет более серьезную опасность, чем может казаться на первый взгляд, а по мере развития методов диагностики приобретает все более и более масштабный характер, о чем говорит в своей статье «На всякий случай…» врач-эндокринолог В.В. Фадеев [28]. Говоря о ЩЖ, большинство пациентов с папиллярным РЩЖ подвергаются оперативному лечению — тотальной тиреоидэктомии или гемитиреоидэктомии [21]. Тем не менее в некоторых исследованиях [22], [23] показано, что при выборе лечения в пользу «активного наблюдения» (active surveillance) у пациентов с папиллярным РЩЖ (который относится к low-risk РЩЖ) диаметром менее одного сантиметра обнаруживались такие же исходы заболевания, как и при выполнении хирургических операций. В связи с этим в 2015 году в клинических рекомендациях Американской тиреоидологической ассоциации (American thyroid association, ATA) впервые была принята стратегия «активного наблюдения» для пациентов с low-risk cancers [24].
В связи с выявленным фактом, что в оперативном лечении таких РЩЖ, вполне возможно, нет необходимости (а ведь удаление ЩЖ сопровождается серьезными последствиями, о чем мы расскажем далее), с 2015 года в США уже принимаются меры по снижению частоты гипердиагностики и гиперлечения [24]. Например, уже настоятельно рекомендовано не проходить скрининг РЩЖ пациентам, у которых нет никаких симптомов, поскольку выявление агрессивных типов рака в этом случае крайне маловероятно.
Еще одной мерой предотвращения гиперлечения является изменение классификации типов РЩЖ, которые ведут себя как доброкачественные. Иначе говоря, их больше не называют «рак». Зачем? Все дело в психологической реакции пациента. Инстинкт самосохранения — самый живучий инстинкт человека и животных. И реализуется он во многом благодаря страху. Благодаря страху антилопа убегает ото льва, а змея жалит потенциальный объект угрозы — животные стремятся выжить. То же и с человеком. Всеми способами человек хочет продлить свое существование на этой земле. И диагноз «рак», который социум привык ассоциировать c мучительным завершением жизни, заставляет человека сделать все, чтобы от этого самого рака избавиться. В нашем случае, если у человека нашли РЩЖ, самая стойкая мысль — избавиться от этого мучения. И в большинстве случаев выбор падает на полное удаление щитовидной железы, вне зависимости от того, необходимо ли это. Как говорится, на всякий случай. И во многих случаях это не оправдано.
В одном из исследований [25] было выяснено, что люди, как правило, имеют общее представление о РЩЖ, но не знают о его диагностике и лечении, полагая, что по распространенности и смертности РЩЖ схож с другими типами рака. Страх дальнейшего прогрессирования заболевания заставляет пациента выбирать радикальное лечение. Так, недавно проведенные исследования неинвазивного рака груди [24], [25], а впоследствии и папиллярного РЩЖ [25], показали влияние терминологии на выбор лечения: замена термина «рак» в описании обоих патологических состояний способствовала выбору пациентом нехирургического лечения. Таким образом, данная стратегия оказывает влияние на психологическое состояние пациентов, тем самым предотвращая гиперлечение. Возможно ли жить с диагнозом «рак»? Как бы ответили на этот вопрос вы?
Что врачи думают о данной проблеме?
Проблема гиперлечения РЩЖ существует не только среди пациентов, но и среди медицинского сообщества.
Конечно, выбор, удалять ли щитовидную железу или нет, стоит больше перед пациентом, нежели перед лечащим врачом. И пациент вполне может выбрать хирургическую тактику лечения. А врач должен определять, сколько ткани щитовидной железы в конкретном случае нужно убирать.
В качестве уменьшения гипердиагностики Американская тиреоидологическая ассоциация рекомендует воздержаться от скрининга и биопсии мелких образований щитовидной железы при отсутствии на то иных клинических симптомов [6].
Как вообще лечат рак щитовидной железы?
Давайте разберемся, какие существуют пути лечения РЩЖ [26].
- Полное удаление ЩЖ, тотальная тиреоидэктомия, вместе с окружающей клетчаткой, а иногда и рядом лежащими лимфатическими узлами.
- Терапия радиоактивным йодом I131 после тотальной тиреиодэктомии. Не пугайтесь — это не опасно! Такой йод влияет только на клетки щитовидной железы и убивает их.
Почему мы, авторы, так не хотим, чтобы щитовидную железу удаляли без серьезных на то причин? Казалось бы, мы уберем орган, где сидит рак, и будем жить себе спокойно, только лишь принимая препараты гормонов щитовидной железы. Это ведь лучше, чем жить с раком. Или все-таки нет? Так вот, сама сложность вопроса заключается в операции.
Чем чревато полное удаление щитовидки (или, как говорят врачи, тотальная тиреоидэктомия)?
Существует два серьезных осложнения тотальной тиреоидэктомии [27].
- Стойкое снижение функции щитовидной железы (гипопаратиреоз). Наиболее серьезное и жизнеугрожающее осложнение. Итак, прямо за щитовидной железой располагаются четыре паращитовидные железы. Они производят паратиреоидный гормон, который отвечает за обмен кальция в нашем организме (а из него состоит бóльшая часть наших костей!). Паращитовидные железы совсем маленькие: диаметром 5 мм и весом 0,5 г. Их легко не заметить во время операции и удалить вместе с щитовидной железой. К тому же, даже если сохранить эти железы, высока вероятность повреждения питающих их кровеносных сосудов и нервов. А значит, железы просто перестанут работать, и в организм перестанет поступать паратиреиодный гормон. Это чревато возникновением тетанических приступов (подергиваний, которые могут переходит в судороги), нарушением питания волос и ногтей, кожи, эмали зубов, а также отложением кальция вне костей, например, между нервными клетками, что может проявляться в виде паркинсонизма или хореоатетоза — комбинации быстрых порывистых движений с медленными судорожными.
- Повреждение возвратного гортанного нерва и парез гортани. Щитовидная железа располагается прямо перед гортанью. Там же рядом находятся голосовые связки. Все эти структуры иннервируются гортанными нервами. И в случае повреждение некоторых из них — возвратных гортанных нервов — у пациента будет наблюдаться уменьшение активности гортанных мышц, что влечет за собой проблемы работы голосовых связок (в основном, осиплость голоса) и нарушения функций дыхания.
Согласитесь, последствия не из приятных. Поэтому главный вопрос заключается в следующем: оправдывают ли риски тиреоидэктомии ее пользу? На данном этапе развития науки и медицины нельзя дать однозначный ответ. Но важно понимать, что диагноз «Рак щитовидной железы» ничего не говорит о прогнозе для пациента и смертность от него крайне низка. А вот неоправданное агрессивное лечение, а именно удаление щитовидной железы, может повлечь за собой инвалидизацию и значительное ухудшение качества жизни. Поэтому сейчас в научном сообществе наблюдается тенденция органосохраняющей тактики в отношении высокодифференцированных РЩЖ. А показания к УЗИ щитовидной железы касаются только специфических групп пациентов. Ведь обнаружение раковых клеток в организме не означает смерть, а вот риск невротизации значительно возрастает.
Какой существует выход?
Одним из наиболее перспективных выходов из ситуации является частичное удаление ткани ЩЖ, а именно поврежденной доли. В таком случае пациент, во-первых, избавляется от необходимости принимать пожизненную заместительную терапию гормонами щитовидной железы, а во-вторых, избегает тех серьезных последствий, которые несет за собой операция полного удаления ЩЖ. Однако стоит понимать, что такой вариант не касается опухолей большого размера, а также тех новообразований, которые потенциально могут быть агрессивными (это решает врач!).
Сейчас терапевты и хирурги, которые занимаются патологией щитовидной железы, разделились на два лагеря: те, кто считает, что лучше перестраховаться, и при выявлении даже самой маленькой опухоли удалить всю щитовидную железу, и те, кто считает, что лучшим выходом будет частичное удаление ткани железы, а именно поврежденной ее доли. К сожалению, этот вопрос до сих пор остается открытым. Врачи все еще не могут прийти к единому знаменателю в данном вопросе. Проблема в том, что достоверная объективная доказательная база, на которую врачи могли бы опираться в качестве актуального клинического руководства, вовсе отсутствует. Существуют лишь отдельные исследования, которые обозревают вопрос лишь с одной субъективной стороны [21]. Оптимальным решением данной проблемы, на наш взгляд, стало бы объединение всех существующих статей с объективным и всесторонним взглядом на этот вопрос. Однако подобное исследование лишь ожидает нас в будущем.
Финальный аккорд
Итак, вот мы и подошли к последним строкам нашей статьи. Могло показаться, что мы и вовсе против УЗИ щитовидной железы, однако это не так. Существует группа риска пациентов, которым необходимо сделать УЗИ щитовидки (например, РЩЖ у кого-то из членов семьи). Также нельзя игнорировать тот факт, что УЗИ сильно продвинуло врачей в ранней диагностике агрессивных быстротекущих форм РЩЖ. Однако бóльшая часть врачей-эндокринологов, особенно за границей, против того, чтобы делать УЗИ щитовидки тогда, когда нет никаких симптомов болезни! Необходимой к прочтению, на наш взгляд, является работа профессора Фадеева В.В. «На всякий случай…» [28].
В этой статье высококвалифицированный врач обращает внимание читателя на то, что часто врачи оценивают результаты лабораторных и инструментальных анализов только на основании общепринятых границ норм. В случае несоответствия данной «норме» пациент признается больным. Очень важно понимать, что человек — индивидуальность, и показатель нормы у каждого может варьировать в зависимости от особенностей организма. Поэтому и лечить мы должны не анализы, не болезнь, а пациента. Врачу необходимо оценивать не только цифры в листе анализов, но и состояние пациента, а также качество жизни, которое ждет человека после лечения. Это и называется клиническим мышлением, которое, к сожалению, зачастую отсутствует у врачей в век, когда мы хотим слепо довериться цифрам, а машина начинает думать за человека.
С этими и другими мыслями вы можете ознакомится по оставленной нами ссылке [26].
Итак, дорогие наши читатели! Опираясь на всё, о чем мы рассказали выше, мы бы хотели, чтобы вы сделали три главных вывода:
- Не делайте УЗИ щитовидной железы «на всякий случай», без каких-либо симптомов! Ни по совету подруги, ни потому, что так сказали по телевизору, ни даже если вам сказал так врач (только если он четко объяснит, зачем нужно делать УЗИ).
- Если у вас нашли узел — 90%, что он доброкачественный.
- Если вы попали в оставшиеся 10%, помните, что бóльшая часть РЩЖ хорошо поддается лечению и имеет благоприятный прогноз.
Всем хорошего дня, и берегите свои щитовидки и нервы. 
- Циберкин А. (2019). Всегда ли нужна биопсия узлов щитовидной железы? «Медфронт»;
- Carolyn Dacey Seib, Julie Ann Sosa. (2019). Evolving Understanding of the Epidemiology of Thyroid Cancer. Endocrinology and Metabolism Clinics of North America. 48, 23-35;
- Hyeong Sik Ahn, Hyun Jung Kim, H. Gilbert Welch. (2014). Korea’s Thyroid-Cancer “Epidemic” — Screening and Overdiagnosis. N Engl J Med. 371, 1765-1767;
- Yasuhiro Ito, Akira Miyauchi, Minoru Kihara, Takuya Higashiyama, Kaoru Kobayashi, Akihiro Miya. (2014). Patient Age Is Significantly Related to the Progression of Papillary Microcarcinoma of the Thyroid Under Observation. Thyroid. 24, 27-34;
- S. Suzuki. (2016). Childhood and Adolescent Thyroid Cancer in Fukushima after the Fukushima Daiichi Nuclear Power Plant Accident: 5 Years On. Clinical Oncology. 28, 263-271;
- Alexandria D. McDow, Susan C. Pitt. (2019). Extent of Surgery for Low-Risk Differentiated Thyroid Cancer. Surgical Clinics of North America. 99, 599-610;
- Toru Takano. (2017). Natural history of thyroid cancer [Review]. Endocr J. 64, 237-244;
- Noone A.M., Howlader N., Krapcho M., Miller D., Brest A., Yu M. et al. SEER cancer statistics review, 1975-2015. Bethesda: National Cancer Institute, 2018;
- A. Kurjak. (2000). Ultrasound scanning – Prof. Ian Donald (1910–1987). European Journal of Obstetrics & Gynecology and Reproductive Biology. 90, 187-189;
- Ian Donald, R.E. Steiner. (1953). RADIOGRAPHY IN THE DIAGNOSIS OF HYALINE MEMBRANE. The Lancet. 262, 846-849;
- Louise Davies, H. Gilbert Welch. (2014). Current Thyroid Cancer Trends in the United States. JAMA Otolaryngol Head Neck Surg. 140, 317;
- Hyeyeun Lim, Susan S. Devesa, Julie A. Sosa, David Check, Cari M. Kitahara. (2017). Trends in Thyroid Cancer Incidence and Mortality in the United States, 1974-2013. JAMA. 317, 1338;
- Antonino Belfiore, Dario Giuffrida, Giacomo L. La Rosa, Orazio Ippolito, Giovanna Russo, et. al.. (1989). High frequency of cancer in cold thyroid nodules occurring at young age. Acta Endocrinologica. 121, 197-202;
- S. Ezzat. (1994). Thyroid incidentalomas. Prevalence by palpation and ultrasonography. Archives of Internal Medicine. 154, 1838-1840;
- Carolyn Dacey Seib, Julie Ann Sosa. (2019). Evolving Understanding of the Epidemiology of Thyroid Cancer. Endocrinology and Metabolism Clinics of North America. 48, 23-35;
- Hyeong Sik Ahn, H. Gilbert Welch. (2015). South Korea’s Thyroid-Cancer “Epidemic” — Turning the Tide. N Engl J Med. 373, 2389-2390;
- Louise Davies, H. Gilbert Welch. (2006). Increasing Incidence of Thyroid Cancer in the United States, 1973-2002. JAMA. 295, 2164;
- A.T. Grady, J.A. Sosa, T.P. Tanpitukpongse, K.R. Choudhury, R.T. Gupta, J.K. Hoang. (2015). Radiology Reports for Incidental Thyroid Nodules on CT and MRI: High Variability across Subspecialties. AJNR Am J Neuroradiol. 36, 397-402;
- Hirsch E.F. (1947). Unnecessary operations. Ill. Med. J. 5;
- Horwitz A. (1947). Unnecessary surgery. Med. Ann. Dist. Columbia. 11, 605–608;
- H. Gilbert Welch, Gerard M. Doherty. (2018). Saving Thyroids — Overtreatment of Small Papillary Cancers. N Engl J Med. 379, 310-312;
- Akira Miyauchi, Yasuhiro Ito, Hitomi Oda. (2018). Insights into the Management of Papillary Microcarcinoma of the Thyroid. Thyroid. 28, 23-31;
- Iwao Sugitani, Kazuhisa Toda, Keiko Yamada, Noriko Yamamoto, Motoko Ikenaga, Yoshihide Fujimoto. (2010). Three Distinctly Different Kinds of Papillary Thyroid Microcarcinoma should be Recognized: Our Treatment Strategies and Outcomes. World J Surg. 34, 1222-1231;
- Benjamin R. Roman, Luc G. Morris, Louise Davies. (2017). The thyroid cancer epidemic, 2017 perspective. Current Opinion in Endocrinology & Diabetes and Obesity. 24, 332-336;
- Brooke Nickel, Caitlin Semsarian, Ray Moynihan, Alexandra Barratt, Susan Jordan, et. al.. (2019). Public perceptions of changing the terminology for low-risk thyroid cancer: a qualitative focus group study. BMJ Open. 9, e025820;
- Дедов И.И. и Мельниченко Г.А. Эндокринология: национальное руководство (2-е изд.). М.: «ГЭОТАР-Медиа», 2019. — 1112 с.;
- Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология: учебник (3-е изд.). М.: «Литтерра», 2015. — 416 с.;
- Фадеев В.В. (2017). На всякий случай… «Клиническая и экспериментальная тиреоидология». 2.
В этой статье вы узнаете:
Основная задача, которая стоит перед врачом при обследовании, является постановка правильного диагноза. И хотя больных часто пугает биопсия щитовидной железы, последствия которой, по их мнению, могут привести к разрастанию рака, эта диагностика приносит больше пользы, чем вреда. Ведь только биопсия щитовидной железы дает возможность постановить точный диагноз при узелковом зобе, и установить со стопроцентной вероятностью доброкачественный этот узел или нет.
- Что это за анализ?
- Показания к проведению
- Виды и способы проведения биопсии
- Подготовка
- Может ли биопсия быть ошибочной?
Что это за анализ?
Биопсия — высокоинформативный способ обследования, применяемый в случае необходимости анализа клеток в определенной анатомической области. Забор тканей с их последующим обследованием с помощью микроскопии дает возможность точно оценить клеточный состав. Без такой процедуры сложно обойтись, если врач подозревает наличие доброкачественного или злокачественного новообразования в определенном органе. Это уточняющее исследование, дополняющее результаты других диагностических процедур. Онколог анализирует результаты биопсии, рентгенографии, эндоскопии и иммунологических тестов совместно.
Онкологические заболевания развиваются быстро и угрожают жизни пациента. Нужно как можно раньше выбрать наиболее эффективную схему лечения. Именно с этой целью проводится биопсия. По результатам процедуры врач приходит к выводу, какие травматичные или даже опасные с точки зрения осложнений способы лечения уместны в данном случае. Подбирается тактика оперативного вмешательства, радиотерапии, химиотерапевтического лечения. Все это было бы невозможно без точного определения типа опухоли, ее стадии и распространенности в организме. Нужны цитологические и гистологические тесты.
В качестве примера можно привести злокачественное новообразование прямой кишки, растущее в нижней части органа. В качестве основного метода лечения выполняется иссечение этой анатомической структуры с последующим формированием колостомы для выделения каловых масс. Если диагноз не был полностью подтвержден, подобное вмешательство не проводят. Оно может по ошибке сделать пациента инвалидом.
Показания к проведению
Подобная диагностическая процедура требуется, если врач предполагает о наличии патологического процесса, подтверждение которого невозможно с помощью других способов исследования. В большинстве случаев это онкологические болезни, однако область применения биопсии ими не ограничивается. Например, такое исследование часто назначают гастроэнтерологи для оценки состояния слизистой оболочки органов пищеварительного тракта. Определяется вид воспалительного процесса, подбирается способ его лечения. В гинекологии и эндокринологии этот метод дает возможность определить причину нарушения фертильности, обнаружить ранние признаки воспаления и дисплазии.
Также биопсия необходима для определения особенностей течения и степени тяжести патологического процесса при болезнях печеночной ткани, почек, головного мозга, мышц и других анатомических структур. Это важно для подбора и изменения схемы медикаментозной терапии. По результатам анализа врач определяет прогностические данные.
Виды и способы проведения биопсии
В современной клинической практике чаще всего используют следующие методики выполнения биопсии:
- Мазки, соскобы и бритвенный метод. Зачастую специалисту требуется небольшое количество материала для постановки диагноза. Можно выполнить мазок и получить все необходимые данные при его последующей микроскопии. Например, такой способ часто применяют в гинекологии. Бритвенная биопсия предполагает иссечение тонкого участка кожного покрова с помощью скальпеля или другого инструмента.
- Тонкоигольная пункция. Такая процедура тоже подходит для случаев, когда достаточно получить немного клеток. В область предполагаемого патологического процесса вводится тонкая игла, захватывающая тканевой образец.
- Толстоигольная пункция. Позволяет произвести забор большого образца тканей без иссечения. Ее назначают при злокачественном новообразовании молочной железы, печеночной ткани, предстательной железы. Трепан-биопсия подходит для исследования кожного покрова, костномозговых структур. Используется специальный инструмент в форме цилиндра.
- Аспирационный метод. Это современная техника забора материала, при котором используется вакуумный прибор в форме цилиндра. В качестве механизма применяется отрицательное давление. Прибор присоединяют к игле. Аспирация дает возможность взять несколько образцов в разных участках анатомической структуры.
- Операционная биопсия. Проводится непосредственно во время операции, когда врач иссекает опухолевую ткань. Это высокоинформативное исследование, позволяющее оценить состояние большого количества тканей. Минус такого вида процедуры — определить тип болезни можно только после операции. Плюсом можно считать совмещение лечебной практики с достоверной диагностикой.
- Эндоскопическая биопсия. Проводится во время диагностики внутренних полостных структур, вроде пищеварительного или респираторного тракта. С помощью эндоскопа врач осматривает подозрительные участки тканей и выбирает место забора материала. Плюсом такой техники можно считать повышенную точность результатов исследования.
Способ проведения диагностики выбирают в зависимости от анамнеза пациента.
Подготовка
В большинстве случаев специально готовиться не следует. Достаточно прийти к врачу в день проведения процедуры и подписать необходимые документы. Специалист объяснит, как будет проходить обследование. Расскажет о рисках и возможных неприятных ощущениях. Определенные виды биопсии выполняют под местным обезболиванием. Реже требуется наркоз. Пациент может сам выбирать комфортный для него способ выполнения диагностики. В случае наркоза нужны специальные подготовительные процедуры.
Для биопсии характерны стандартные осложнения, возникающие при других видах вмешательств. Возможно кровоизлияние, инфицирование тканей. Реже возникает травматизация внутренних органов. Такие негативные последствия редки, но врач обязательно уведомляет пациента о рисках.
Может ли биопсия быть ошибочной?
Достоверность исследования зависит от способа его проведения, анамнеза пациента, опыта врача и других факторов. Например, при пункции специалист может получить образец тканей без злокачественных клеток, если игла попала в соседнюю с опухолью область. В этом случае возможен ложноположительный результат. Онкологи учитывают такую вероятность, и всегда назначают уточняющие исследования. Диагноз не ставится только на основе результатов одной процедуры. Всегда проводится комплексная оценка состояния организма.
Статья на конкурс «био/мол/текст»: Рак — та проблема, которая так или иначе волнует каждого из нас, а некоторых, к сожалению, коснулась напрямую. Сегодня заболеваемость онкологическими патологиями неуклонно растет. Однако сейчас мы бы хотели поговорить с вами о том виде рака, который бояться в большинстве случаев совсем не нужно! Это рак щитовидной железы. Заинтригованы? Читайте эту статью.
Несомненно, XXI век — время развития научно-технического прогресса. Вместе с совершенствованием технологий приходит и их доступность в повсеместном использовании. Медицина не является исключением. Благодаря развитию технологий диагностики и лечения самых разных заболеваний мы стали спасать тех пациентов, которые когда-то входили в число неизлечимых. Однако не на все сферы медицины прогресс повлиял так положительно. Поэтому сегодня мы бы хотели познакомить вас с такими животрепещущими вопросами медицины, как гипердиагностика и гиперлечение. Сейчас мы остановимся лишь на одной, но весьма значимой стороне данной проблемы — гипердиагностика узлов щитовидной железы, а также гиперлечение этих узлов и рака щитовидной железы.
Что мы знаем сегодня про узлы щитовидной железы?
26 сентября 2019 года в группе «Медфронт» во «ВКонтакте» появилась небольшая статья Александра Циберкина, врача-эндокринолога, создателя блога «Занимательная эндокринология» [1]. Проблема, которая поднималась в статье, достаточно проста: многим из нас когда-то предлагали сделать УЗИ щитовидной железы на всякий случай. На наш взгляд, Александр рассказывает о проблеме гипердиагностики и гиперлечения для того, чтобы врачи всерьез задумались, правильно ли назначать не всегда нужные анализы всем, и насколько серьезной проблемой является обнаружение узла в щитовидной железе в процессе такого скрининга.
Однако то, что эта проблема была озвучена совсем недавно, не значит, что о ней больше не надо писать. Мы не хотим загружать вас медицинской терминологией, вновь писать о TI-RADS и разбирать по кусочкам, что может написать функциональный диагност в заключении. Мы обращаемся к вам в качестве потенциальных пациентов и хотим донести мысль, что не всегда узел в щитовидной железе опасен, а рак априори смертелен.
База, с которой нам нужно познакомиться: щитовидная железа
Немножко о щитовидной железе (ЩЖ). Это орган эндокринной системы человека, который располагается на передней поверхности шеи в области гортани, прямо перед щитовидным хрящом. Состоит железа из левой и правой долей и перешейка. ЩЖ богато кровоснабжается разными артериями, а иннервируется гортанными нервами.
Главной функцией щитовидной железы (лат. glandula thyroidea) является синтез тиреоидных гормонов, необходимых нашему организму. Под тиреоидными гормонами мы подразумеваем два соединения: тироксин (Т4) и трийодтиронин (Т3). Основной функцией Т4 и Т3 является увеличение потребления клетками кислорода. Иначе говоря, эти гормоны стимулируют все энергетические процессы в клетке и обмен веществ, причем их влияние распространяется на все клетки организма.
Также клетки ЩЖ производят кальцитонин, ответственный за обмен кальция в организме.
Прямо за щитовидной железой располагаются четыре небольшие паращитовидные железы. Последние производят паратиреоидный гормон, который также отвечает за поддержание уровня кальция в организме, причем в большей степени, чем кальцитонин.
Откуда берется столько случаев рака щитовидки?
Рак щитовидной железы (РЩЖ) — наиболее распространенное злокачественное новообразование эндокринной системы [2]. Все чаще мы слышим, что заболеваемость РЩЖ неуклонно растет. И звучит это ужасающе, однако так ли всё просто на самом деле? Возможно, вы будете шокированы, какая правда скрывается за этими, на первый взгляд, однозначными научными фактами. И прежде, чем мы разберемся с истинной причиной роста заболеваемости РЩЖ, необходимо ознакомиться с тем, какие виды рака щитовидки существуют.
Итак, начнем. Сейчас нам понадобится привести немного численных данных, но не пугайтесь их, всё крайне просто. В научном сообществе выделяют пять типов РЩЖ:
- Папиллярный (80–85% случаев).
- Фолликулярный (10–15% случаев).
- Медуллярный (5% случаев).
- Низкодифференцированный (1% случаев).
- Недифференцированный (0,1–0,2% случаев).
Наиболее благоприятными принято считать два первых типа РЩЖ. И как мы можем заметить, они встречаются наиболее часто. Их также называют высокодифференцированными типами рака. Медуллярный, низкодифференцированный и недифференцированный типы считаются агрессивными формами РЩЖ. В нашей статье мы сделаем акцент лишь на первых двух типах РЩЖ, так как они являются наиболее распространенными.
Что означает понятие «дифференцировка»?
Когда-то давно, еще до нашего рождения, каждый из нас представлял собой одну-единственную клетку. Во время внутриутробного развития клеток стало в триллионы раз больше! И каждая из них обрела свою собственную функцию: одни отвечают за биение нашего сердца, другие защищают наш организм от внешних и внутренних опасностей, а третьи отвечают за когнитивные функции. И таких видов клеток более 230! Путь, который проходит клетка от той единственной, стоявшей в начале нашего пути, до высоко специализированной клетки, у которой есть четкие обязанности, и называется «дифференцировка».
Что касается рака — если клетки, из которых состоит опухоль, являются высокодифференцированными, в большинстве случаев врачи считают исход благоприятным. Однако если опухоль состоит из низкодифференцированных клеток, то с большой вероятностью она склонна к агрессивному течению. Как уже было сказано, наиболее часто выявляемые РЩЖ являются высокодифференцированными.
Папиллярный РЩЖ — наиболее распространенная форма: 80–85%. И с самым хорошим прогнозом. Пятилетняя выживаемость пациентов с РЩЖ — 98,1% [2]. Что это значит для пациента? Что наиболее часто выявляемые случаи РЩЖ имеют благоприятный исход!
Рак, ушедший в себя
Наше традиционное понимание РЩЖ, а именно его развития, в корне изменилось благодаря трем исследованиям 2014 года (Thyroid cancer trilogy) [3–5]. Казалось бы, все злокачественные образования по мере развития подвергаются прогрессии, а потому нуждаются в ранней диагностике и оперативном лечении. Впервые за всю историю человека было обнаружено существование «самоограничивающихся раков» (self-limiting cancers), которые являются злокачественными, но при этом не прогрессируют в летальные формы из-за ограниченной способности к делению клеток, составляющих опухоль. Конечно же, существуют и так называемые летальные РЩЖ (lethal thyroid cancers). Различие между ними заключается в происхождении раковых клеток, что и определяет развитие заболевания и его исход. Во втором случае клетки как бы затаиваются на долгий срок, на годы и даже на десятилетия, а потом по невыясненным еще причинам внезапно начинают делиться и приводят к неблагоприятному исходу. Однако на данный момент считается, что именно «самоограничивающиеся» типы РЩЖ составляют большинство.
Подбираемся к корню проблемы: статистика и диагностика
Вернемся к распространенности РЩЖ. Теперь мы готовы понять, что возросшее число случаев данной патологии не является поводом для беспокойства.
В 1975 году заболеваемость РЩЖ составляла 4,9 на 100 000 человек и оставалась относительно стабильной до начала 1990-х годов [6]. За последние 25 лет заболеваемость РЩЖ выросла более чем в 3 раза, то есть на 300% (рис. 1) [7], [8], причем в большинстве случаев за счет высокодифференцированного папиллярного РЩЖ. При этом очень важно понимать, что, несмотря на такой значительный рост, смертность от РЩЖ остается стабильной, примерно 0,5 случаев на 100 000 человек [6].
Рисунок 1. Данные заболеваемости раком щитовидной железы в период с 1975 по 2015 годы
Чувствуете, что тут что-то не так? Нет связи между возросшим числом случаев РЩЖ и смертностью от этой патологии! Среди врачей и ученых до сих пор продолжаются дебаты, почему так происходит. Сейчас выделяют несколько теорий. Наиболее вероятная — широкое распространение методов ультразвуковой диагностики (УЗИ). Пусть корни УЗИ уходят к Леонардо да Винчи и XV веку, широкое медицинское распространение данный метод получил с 50-х годов XX века [9], [10]. Сегодня УЗИ является наиболее простым, дешевым, неинвазивным и информативным методом выявления опухолевых образований щитовидной железы. Поэтому, как вы можете догадаться, УЗИ стали делать почти всем, причем независимо от показаний.
Сейчас научное сообщество активно дискутирует на тему, связаны ли такие показатели с истинным увеличением заболеваемости РЩЖ, или же проблема в гипердиагностике тех небольших образований ЩЖ, которые не требуют никакого вмешательства со стороны человека [11], [12].
Для более полного понимания проблемы вернемся на чуть более ранний этап диагностики РЩЖ.
Что такое узлы и как их найти?
Узлы ЩЖ — это радиологически различимые объемные образования в ЩЖ, которые могут быть доброкачественными и злокачественными. Узлы можно найти в 50% случаев всех проводимых УЗИ ЩЖ. При этом только 5% выявляемых образований будут злокачественными [13], [14].
Весомый вклад УЗИ в возросшее количество диагностированных узлов и РЩЖ можно показать на примере одного нашумевшего исследования в Южной Корее [3], [15], [16]. В 1999 году там была утверждена национальная программа, направленная на скрининг злокачественных заболеваний. Под программу попала и щитовидная железы. В результате повсеместного внедрения УЗИ щитовидки частота выявления рака выросла в 15 (!) раз с 1993 по 2011 год. И это мы еще не говорим просто об узлах, которые также могут быть психологической проблемой пациента. Большинство выявляемых случаев — папиллярный РЩЖ. Как вы помните, этот вид рака имеет весьма благоприятный исход. Однако простому населению идея жить с раком настолько чужда и неприятна, что было проведено огромное число полного удаления щитовидных желез, причем часто без видимой на то необходимости! А такая операция имеет серьезные последствия, о которых мы расскажем чуть ниже.
Врачи, осознав свою ошибку, убрали УЗИ щитовидки из списка обязательных скрининговых тестов. И результат не заставил себя ждать. В последней на эту тему публикации 2015 года сказано, что на 30% снизилась заболеваемость РЩЖ, а число операций на щитовидной железе снижалось на 35% ежегодно. Вывод напрашивается сам собой: в основе увеличения числа диагностированных случаев узлов щитовидки (в том числе и РЩЖ) является ставшее таким доступным УЗИ.
Думаем, следует также сказать, что образования ЩЖ выявляются не только при выполнении УЗИ, но и при использовании других методов лучевой диагностики (КТ, МРТ, ПЭТ), что стало возможным благодаря улучшению разрешающей способности оборудования. Следовательно, увеличилось чисто случайно выявляемых образований щитовидной железы (в том числе, рака) — инциденталóм (от англ. incidence — случайность) [17]. Инциденталомы клинически никак себя не проявляют и могут оставаться в организме бессимптомно всю жизнь. И многие из таких инциденталом обнаруживались лишь посмертно, случайно, и не являлись причиной кончины человека. Это позволяет говорить нам о существовании резервуара пациентов с узлами или раком щитовидной железы, который клинически является скрытым и никак себя не проявляет до его случайного обнаружения [18].
Приведенные данные обобщены на рисунке 2.
Рисунок 2. Что даст нам УЗИ щитовидки на самом деле?
рисунок авторов статьи
Напомним, что в нашей статье мы делаем акцент на наиболее распространенных типах РЩЖ (папиллярный, фолликулярный). Агрессивные формы РЩЖ (медуллярный, низкодифференцированный, недифференцированный и редко папиллярный) требуют дальнейшего более детального изучения
Самое главное: почему гипердиагностика и гиперлечение РЩЖ являются проблемой?
Является ли столь чрезмерное выявление объемных образований ЩЖ проблемой? Да, и очень даже серьезной. И она получила свое название — гипердиагностика (overdiagnosis) [19], [20]. И проблема состоит в том, что следствием ее становится гиперлечение. На самом деле она касается не только ЩЖ и представляет более серьезную опасность, чем может казаться на первый взгляд, а по мере развития методов диагностики приобретает все более и более масштабный характер, о чем говорит в своей статье «На всякий случай…» врач-эндокринолог В.В. Фадеев [28]. Говоря о ЩЖ, большинство пациентов с папиллярным РЩЖ подвергаются оперативному лечению — тотальной тиреоидэктомии или гемитиреоидэктомии [21]. Тем не менее в некоторых исследованиях [22], [23] показано, что при выборе лечения в пользу «активного наблюдения» (active surveillance) у пациентов с папиллярным РЩЖ (который относится к low-risk РЩЖ) диаметром менее одного сантиметра обнаруживались такие же исходы заболевания, как и при выполнении хирургических операций. В связи с этим в 2015 году в клинических рекомендациях Американской тиреоидологической ассоциации (American thyroid association, ATA) впервые была принята стратегия «активного наблюдения» для пациентов с low-risk cancers [24].
В связи с выявленным фактом, что в оперативном лечении таких РЩЖ, вполне возможно, нет необходимости (а ведь удаление ЩЖ сопровождается серьезными последствиями, о чем мы расскажем далее), с 2015 года в США уже принимаются меры по снижению частоты гипердиагностики и гиперлечения [24]. Например, уже настоятельно рекомендовано не проходить скрининг РЩЖ пациентам, у которых нет никаких симптомов, поскольку выявление агрессивных типов рака в этом случае крайне маловероятно.
Еще одной мерой предотвращения гиперлечения является изменение классификации типов РЩЖ, которые ведут себя как доброкачественные. Иначе говоря, их больше не называют «рак». Зачем? Все дело в психологической реакции пациента. Инстинкт самосохранения — самый живучий инстинкт человека и животных. И реализуется он во многом благодаря страху. Благодаря страху антилопа убегает ото льва, а змея жалит потенциальный объект угрозы — животные стремятся выжить. То же и с человеком. Всеми способами человек хочет продлить свое существование на этой земле. И диагноз «рак», который социум привык ассоциировать c мучительным завершением жизни, заставляет человека сделать все, чтобы от этого самого рака избавиться. В нашем случае, если у человека нашли РЩЖ, самая стойкая мысль — избавиться от этого мучения. И в большинстве случаев выбор падает на полное удаление щитовидной железы, вне зависимости от того, необходимо ли это. Как говорится, на всякий случай. И во многих случаях это не оправдано.
В одном из исследований [25] было выяснено, что люди, как правило, имеют общее представление о РЩЖ, но не знают о его диагностике и лечении, полагая, что по распространенности и смертности РЩЖ схож с другими типами рака. Страх дальнейшего прогрессирования заболевания заставляет пациента выбирать радикальное лечение. Так, недавно проведенные исследования неинвазивного рака груди [24], [25], а впоследствии и папиллярного РЩЖ [25], показали влияние терминологии на выбор лечения: замена термина «рак» в описании обоих патологических состояний способствовала выбору пациентом нехирургического лечения. Таким образом, данная стратегия оказывает влияние на психологическое состояние пациентов, тем самым предотвращая гиперлечение. Возможно ли жить с диагнозом «рак»? Как бы ответили на этот вопрос вы?
Что врачи думают о данной проблеме?
Проблема гиперлечения РЩЖ существует не только среди пациентов, но и среди медицинского сообщества.
Конечно, выбор, удалять ли щитовидную железу или нет, стоит больше перед пациентом, нежели перед лечащим врачом. И пациент вполне может выбрать хирургическую тактику лечения. А врач должен определять, сколько ткани щитовидной железы в конкретном случае нужно убирать.
В качестве уменьшения гипердиагностики Американская тиреоидологическая ассоциация рекомендует воздержаться от скрининга и биопсии мелких образований щитовидной железы при отсутствии на то иных клинических симптомов [6].
Как вообще лечат рак щитовидной железы?
Давайте разберемся, какие существуют пути лечения РЩЖ [26].
- Полное удаление ЩЖ, тотальная тиреоидэктомия, вместе с окружающей клетчаткой, а иногда и рядом лежащими лимфатическими узлами.
- Терапия радиоактивным йодом I131 после тотальной тиреиодэктомии. Не пугайтесь — это не опасно! Такой йод влияет только на клетки щитовидной железы и убивает их.
Почему мы, авторы, так не хотим, чтобы щитовидную железу удаляли без серьезных на то причин? Казалось бы, мы уберем орган, где сидит рак, и будем жить себе спокойно, только лишь принимая препараты гормонов щитовидной железы. Это ведь лучше, чем жить с раком. Или все-таки нет? Так вот, сама сложность вопроса заключается в операции.
Чем чревато полное удаление щитовидки (или, как говорят врачи, тотальная тиреоидэктомия)?
Существует два серьезных осложнения тотальной тиреоидэктомии [27].
- Стойкое снижение функции щитовидной железы (гипопаратиреоз). Наиболее серьезное и жизнеугрожающее осложнение. Итак, прямо за щитовидной железой располагаются четыре паращитовидные железы. Они производят паратиреоидный гормон, который отвечает за обмен кальция в нашем организме (а из него состоит бóльшая часть наших костей!). Паращитовидные железы совсем маленькие: диаметром 5 мм и весом 0,5 г. Их легко не заметить во время операции и удалить вместе с щитовидной железой. К тому же, даже если сохранить эти железы, высока вероятность повреждения питающих их кровеносных сосудов и нервов. А значит, железы просто перестанут работать, и в организм перестанет поступать паратиреиодный гормон. Это чревато возникновением тетанических приступов (подергиваний, которые могут переходит в судороги), нарушением питания волос и ногтей, кожи, эмали зубов, а также отложением кальция вне костей, например, между нервными клетками, что может проявляться в виде паркинсонизма или хореоатетоза — комбинации быстрых порывистых движений с медленными судорожными.
- Повреждение возвратного гортанного нерва и парез гортани. Щитовидная железа располагается прямо перед гортанью. Там же рядом находятся голосовые связки. Все эти структуры иннервируются гортанными нервами. И в случае повреждение некоторых из них — возвратных гортанных нервов — у пациента будет наблюдаться уменьшение активности гортанных мышц, что влечет за собой проблемы работы голосовых связок (в основном, осиплость голоса) и нарушения функций дыхания.
Согласитесь, последствия не из приятных. Поэтому главный вопрос заключается в следующем: оправдывают ли риски тиреоидэктомии ее пользу? На данном этапе развития науки и медицины нельзя дать однозначный ответ. Но важно понимать, что диагноз «Рак щитовидной железы» ничего не говорит о прогнозе для пациента и смертность от него крайне низка. А вот неоправданное агрессивное лечение, а именно удаление щитовидной железы, может повлечь за собой инвалидизацию и значительное ухудшение качества жизни. Поэтому сейчас в научном сообществе наблюдается тенденция органосохраняющей тактики в отношении высокодифференцированных РЩЖ. А показания к УЗИ щитовидной железы касаются только специфических групп пациентов. Ведь обнаружение раковых клеток в организме не означает смерть, а вот риск невротизации значительно возрастает.
Какой существует выход?
Одним из наиболее перспективных выходов из ситуации является частичное удаление ткани ЩЖ, а именно поврежденной доли. В таком случае пациент, во-первых, избавляется от необходимости принимать пожизненную заместительную терапию гормонами щитовидной железы, а во-вторых, избегает тех серьезных последствий, которые несет за собой операция полного удаления ЩЖ. Однако стоит понимать, что такой вариант не касается опухолей большого размера, а также тех новообразований, которые потенциально могут быть агрессивными (это решает врач!).
Сейчас терапевты и хирурги, которые занимаются патологией щитовидной железы, разделились на два лагеря: те, кто считает, что лучше перестраховаться, и при выявлении даже самой маленькой опухоли удалить всю щитовидную железу, и те, кто считает, что лучшим выходом будет частичное удаление ткани железы, а именно поврежденной ее доли. К сожалению, этот вопрос до сих пор остается открытым. Врачи все еще не могут прийти к единому знаменателю в данном вопросе. Проблема в том, что достоверная объективная доказательная база, на которую врачи могли бы опираться в качестве актуального клинического руководства, вовсе отсутствует. Существуют лишь отдельные исследования, которые обозревают вопрос лишь с одной субъективной стороны [21]. Оптимальным решением данной проблемы, на наш взгляд, стало бы объединение всех существующих статей с объективным и всесторонним взглядом на этот вопрос. Однако подобное исследование лишь ожидает нас в будущем.
Финальный аккорд
Итак, вот мы и подошли к последним строкам нашей статьи. Могло показаться, что мы и вовсе против УЗИ щитовидной железы, однако это не так. Существует группа риска пациентов, которым необходимо сделать УЗИ щитовидки (например, РЩЖ у кого-то из членов семьи). Также нельзя игнорировать тот факт, что УЗИ сильно продвинуло врачей в ранней диагностике агрессивных быстротекущих форм РЩЖ. Однако бóльшая часть врачей-эндокринологов, особенно за границей, против того, чтобы делать УЗИ щитовидки тогда, когда нет никаких симптомов болезни! Необходимой к прочтению, на наш взгляд, является работа профессора Фадеева В.В. «На всякий случай…» [28].
В этой статье высококвалифицированный врач обращает внимание читателя на то, что часто врачи оценивают результаты лабораторных и инструментальных анализов только на основании общепринятых границ норм. В случае несоответствия данной «норме» пациент признается больным. Очень важно понимать, что человек — индивидуальность, и показатель нормы у каждого может варьировать в зависимости от особенностей организма. Поэтому и лечить мы должны не анализы, не болезнь, а пациента. Врачу необходимо оценивать не только цифры в листе анализов, но и состояние пациента, а также качество жизни, которое ждет человека после лечения. Это и называется клиническим мышлением, которое, к сожалению, зачастую отсутствует у врачей в век, когда мы хотим слепо довериться цифрам, а машина начинает думать за человека.
С этими и другими мыслями вы можете ознакомится по оставленной нами ссылке [26].
Итак, дорогие наши читатели! Опираясь на всё, о чем мы рассказали выше, мы бы хотели, чтобы вы сделали три главных вывода:
- Не делайте УЗИ щитовидной железы «на всякий случай», без каких-либо симптомов! Ни по совету подруги, ни потому, что так сказали по телевизору, ни даже если вам сказал так врач (только если он четко объяснит, зачем нужно делать УЗИ).
- Если у вас нашли узел — 90%, что он доброкачественный.
- Если вы попали в оставшиеся 10%, помните, что бóльшая часть РЩЖ хорошо поддается лечению и имеет благоприятный прогноз.
Всем хорошего дня, и берегите свои щитовидки и нервы. 
- Циберкин А. (2019). Всегда ли нужна биопсия узлов щитовидной железы? «Медфронт»;
- Carolyn Dacey Seib, Julie Ann Sosa. (2019). Evolving Understanding of the Epidemiology of Thyroid Cancer. Endocrinology and Metabolism Clinics of North America. 48, 23-35;
- Hyeong Sik Ahn, Hyun Jung Kim, H. Gilbert Welch. (2014). Korea’s Thyroid-Cancer “Epidemic” — Screening and Overdiagnosis. N Engl J Med. 371, 1765-1767;
- Yasuhiro Ito, Akira Miyauchi, Minoru Kihara, Takuya Higashiyama, Kaoru Kobayashi, Akihiro Miya. (2014). Patient Age Is Significantly Related to the Progression of Papillary Microcarcinoma of the Thyroid Under Observation. Thyroid. 24, 27-34;
- S. Suzuki. (2016). Childhood and Adolescent Thyroid Cancer in Fukushima after the Fukushima Daiichi Nuclear Power Plant Accident: 5 Years On. Clinical Oncology. 28, 263-271;
- Alexandria D. McDow, Susan C. Pitt. (2019). Extent of Surgery for Low-Risk Differentiated Thyroid Cancer. Surgical Clinics of North America. 99, 599-610;
- Toru Takano. (2017). Natural history of thyroid cancer [Review]. Endocr J. 64, 237-244;
- Noone A.M., Howlader N., Krapcho M., Miller D., Brest A., Yu M. et al. SEER cancer statistics review, 1975-2015. Bethesda: National Cancer Institute, 2018;
- A. Kurjak. (2000). Ultrasound scanning – Prof. Ian Donald (1910–1987). European Journal of Obstetrics & Gynecology and Reproductive Biology. 90, 187-189;
- Ian Donald, R.E. Steiner. (1953). RADIOGRAPHY IN THE DIAGNOSIS OF HYALINE MEMBRANE. The Lancet. 262, 846-849;
- Louise Davies, H. Gilbert Welch. (2014). Current Thyroid Cancer Trends in the United States. JAMA Otolaryngol Head Neck Surg. 140, 317;
- Hyeyeun Lim, Susan S. Devesa, Julie A. Sosa, David Check, Cari M. Kitahara. (2017). Trends in Thyroid Cancer Incidence and Mortality in the United States, 1974-2013. JAMA. 317, 1338;
- Antonino Belfiore, Dario Giuffrida, Giacomo L. La Rosa, Orazio Ippolito, Giovanna Russo, et. al.. (1989). High frequency of cancer in cold thyroid nodules occurring at young age. Acta Endocrinologica. 121, 197-202;
- S. Ezzat. (1994). Thyroid incidentalomas. Prevalence by palpation and ultrasonography. Archives of Internal Medicine. 154, 1838-1840;
- Carolyn Dacey Seib, Julie Ann Sosa. (2019). Evolving Understanding of the Epidemiology of Thyroid Cancer. Endocrinology and Metabolism Clinics of North America. 48, 23-35;
- Hyeong Sik Ahn, H. Gilbert Welch. (2015). South Korea’s Thyroid-Cancer “Epidemic” — Turning the Tide. N Engl J Med. 373, 2389-2390;
- Louise Davies, H. Gilbert Welch. (2006). Increasing Incidence of Thyroid Cancer in the United States, 1973-2002. JAMA. 295, 2164;
- A.T. Grady, J.A. Sosa, T.P. Tanpitukpongse, K.R. Choudhury, R.T. Gupta, J.K. Hoang. (2015). Radiology Reports for Incidental Thyroid Nodules on CT and MRI: High Variability across Subspecialties. AJNR Am J Neuroradiol. 36, 397-402;
- Hirsch E.F. (1947). Unnecessary operations. Ill. Med. J. 5;
- Horwitz A. (1947). Unnecessary surgery. Med. Ann. Dist. Columbia. 11, 605–608;
- H. Gilbert Welch, Gerard M. Doherty. (2018). Saving Thyroids — Overtreatment of Small Papillary Cancers. N Engl J Med. 379, 310-312;
- Akira Miyauchi, Yasuhiro Ito, Hitomi Oda. (2018). Insights into the Management of Papillary Microcarcinoma of the Thyroid. Thyroid. 28, 23-31;
- Iwao Sugitani, Kazuhisa Toda, Keiko Yamada, Noriko Yamamoto, Motoko Ikenaga, Yoshihide Fujimoto. (2010). Three Distinctly Different Kinds of Papillary Thyroid Microcarcinoma should be Recognized: Our Treatment Strategies and Outcomes. World J Surg. 34, 1222-1231;
- Benjamin R. Roman, Luc G. Morris, Louise Davies. (2017). The thyroid cancer epidemic, 2017 perspective. Current Opinion in Endocrinology & Diabetes and Obesity. 24, 332-336;
- Brooke Nickel, Caitlin Semsarian, Ray Moynihan, Alexandra Barratt, Susan Jordan, et. al.. (2019). Public perceptions of changing the terminology for low-risk thyroid cancer: a qualitative focus group study. BMJ Open. 9, e025820;
- Дедов И.И. и Мельниченко Г.А. Эндокринология: национальное руководство (2-е изд.). М.: «ГЭОТАР-Медиа», 2019. — 1112 с.;
- Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология: учебник (3-е изд.). М.: «Литтерра», 2015. — 416 с.;
- Фадеев В.В. (2017). На всякий случай… «Клиническая и экспериментальная тиреоидология». 2.
В этой статье вы узнаете:
Основная задача, которая стоит перед врачом при обследовании, является постановка правильного диагноза. И хотя больных часто пугает биопсия щитовидной железы, последствия которой, по их мнению, могут привести к разрастанию рака, эта диагностика приносит больше пользы, чем вреда. Ведь только биопсия щитовидной железы дает возможность постановить точный диагноз при узелковом зобе, и установить со стопроцентной вероятностью доброкачественный этот узел или нет.
Так что подразумевают под этой процедурой?
Полное название биопсии или пункции щитовидки звучит следующим образом: тонкоигольная аспирационная биопсия щитовидной железы. Подобное название полностью описывает сам процесс пункции. Врач вводит тонкую иглу в узелковое образование, что контролируется на УЗИ. После того, как кончик иглы оказался внутри узла, проводится аспирация. Имеется в виду, что врач проводит несколько коротких всасываний иглой содержимого узла щитовидной железы. После аспирации врач наносит полученное содержимое на лабораторное стекло.
Таких пункций (уколов) проводится несколько, каждый раз в новом узле. Это необходимо для более точного анализа полученного материала.
Все процедура происходит очень быстро и легко переносится больными. По окончанию процедуры на место пункции наклеивается специальный пластырь, после чего пациент может заниматься своими делами. Единственное предостережение: не мочить пластырь на протяжении двух часов после биопсии.

Таким образом, бояться нужно не биопсии щитовидной железы, а возможных последствий негативного характера при отказе от ее проведения, поскольку в таком случае поставленный диагноз может быть ошибочным.
В настоящее время возможно пять вариантов заключения исследования:
- Коллоидный узел – позитивный результат, поскольку предполагает, что клетки отобранной пункции являются доброкачественными и не могут переродиться в дальнейшем в злокачественную опухоль;
- Аутоиммунный тиреоидит – также позитивный результат, поскольку узел образовался вследствие воспаления, как аутоиммунный ответ организма. Вероятность перерождения узла очень низкая;
- Фолликулярная опухоль – промежуточный результат. Отмечен процесс злокачественных преобразований, но сама опухоль может быть как злокачественной (около 15%), так и доброкачественной (около 85%);
- Наличие лимфомы, папиллярной, анапластической или плоскоклеточной карциномы, медуллярной карциномы – негативный результат, поскольку указанные образования являются злокачественными;
- Неинформативность материала – предполагает необходимость в повторном обследовании.
Показания
Широкое распространение тонкоигольная аспирационная биопсия щитовидной железы получила в связи с возможностью очень точно провести оценку качественности (до 95%) при исследовании клеток тканей. Но именно широкое распространение позволило определить и ее недостатки:
- При исследовании маленьких узлов (до 1 см) количество ошибочный результатов возрастает, что делает проведение такого исследования в подобных случаях нецелесообразным;
- Б-клеточные опухоли при биопсии щитовидной железы определить практически невозможно, например, невозможно провести дифференциацию фолликулярной карциномы;
- Фолликулярный вариант папиллярной карциномы определяется с очень низкой диагностической точностью;
- Подготовка персонала, который проводит биопсию щитовидной железы, а также анализ полученного материала должна быть на высоком уровне. В противном случае количество ошибочный и неинформативных результатов увеличивается.

Показания к проведению обследования:
- Размеры узловых образований превышают 1 см;
- Данные ультразвука указывают на злокачественные узлы, в том числе меньше 1 см. При этом проводится биопсия не всех узлов щитовидки, или наиболее крупных, а только тех, у которых подозревается злокачественный рост;
- Компрессия структур щитовидной железы и последующее хирургическое вмешательство;
- Необходимость склеротерапии этанолом. В этом случае биопсия щитовидной железы проводится с целью подтвердить тот факт, что узел доброкачественный.
Все остальные случаи узловых заболеваний щитовидной железы можно определить с помощью ультразвукового обследования и оценки его результатов специалистами.
Противопоказания и возможные последствия биопсии щитовидки
Последствия биопсии щитовидной железы, как правило, отсутствуют. Поэтому не нужно бояться, что после ее проведения произойдет резкое разрастание раковых клеток. Рост опухоли после биопсии в большинстве случаев связано с тем, что при ее проведении размеры узлов составляли меньше 1 см. В этом случае возможность ошибки при диагностике значительно возрастает. Также причинами появления опухоли уже после биопсии щитовидной железы и позитивного результата может быть недостаточная профессиональность персонала, из-за чего был выдан ошибочный результат.
Основными же последствиями биопсии щитовидной железы является возникновение гематомы в месте проведения пункции или асептическое воспаление тканей, хотя подобное бывает очень редко. Также возможны последствия, причиной которых является сам больной. Имеется в виду обморок, из-за излишней боязни.
Противопоказаний к проведению процедуры также нет. Нужно только учитывать, что в некоторых случаях может быть применен внутривенный наркоз, особенно это касается маленьких детей, а также психически неуравновешенных больных.