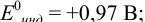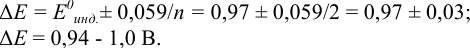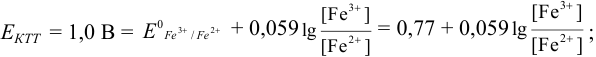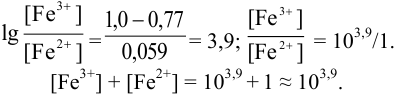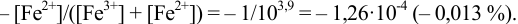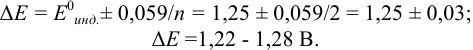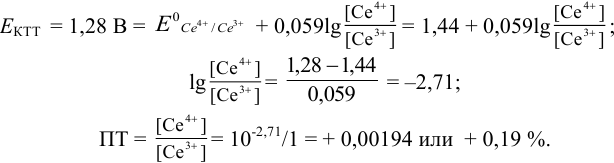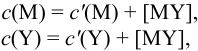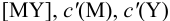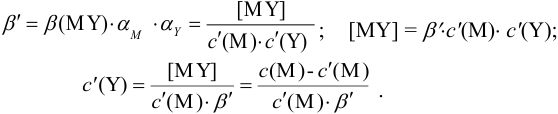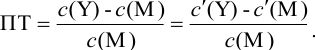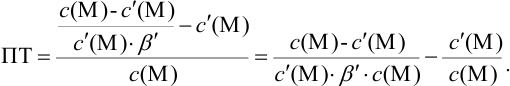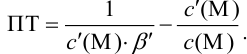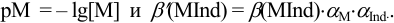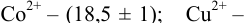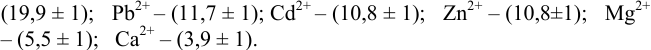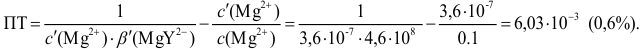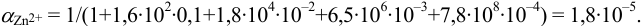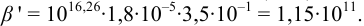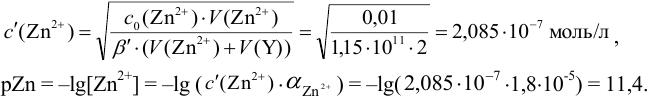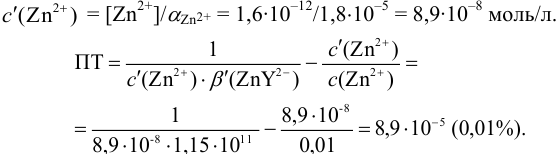
Результаты титрования CH3COOH раствором NaOH представлены в табл. 16.
Таблица 16 Данные для построения кривой титрования CH3COOH
раствором NaOH
На основе этих данных строят кривую титрования
CH3COOH раствором NaOH, рис. 10.
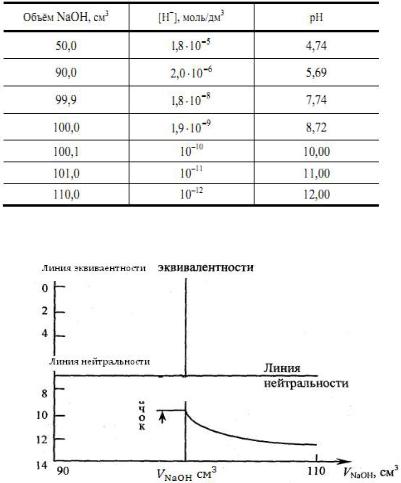
Рис. 10. Общий вид кривых тирования слабой кислоты раствором сильного основания
101

Анализ кривой титрования:
–ТЭ находится в щелочной среде рН = 8,72;
–исходная точка титрования находится в менее кислой
среде, чем при титровании сильной кислоты;
–скачок титрования невелик (7,74 — 10,00); при титровании следует использовать в качестве индикатора фенолфталеин;
–кривая несимметрична по отношению к линии нейтральности.
Величина скачка титрования зависит от концентрации и температуры, а также константы диссоциации кислоты. Если

Ошибки кислотно-основного титрования
Результаты определения содержания какого-либо компонента при проведении количественного анализа всегда отличаются от его истинного значения. Эти ошибки могут быть как случайными, так и систематическими и имеют различную природу.
1. Субъективные ошибки обусловлены несовершенством измерительных приборов и глаза, неточностью взвешивания. Для уменьшения этих ошибок следует пользоваться градуированной измерительной посудой (бюретки, пипетки, мерные колбы). Расход титранта
вбюретке должен быть не менее 15 – 25 см3.
2.Индикаторные ошибки. Иногда индикаторную
ошибку титрования называют просто ошибкой титрования, величина, найденная в конечной точке, за вычетом величины, отвечающей точке эквивалентности. Такое определение универсально и справедливо для всех титриметрических методов. Эти ошибки обусловлены тем, что титрование должно быть закончено при pH = 7, а практически при использовании индикаторов оно заканчивается либо в кислой, либо в щелочной средах.
102
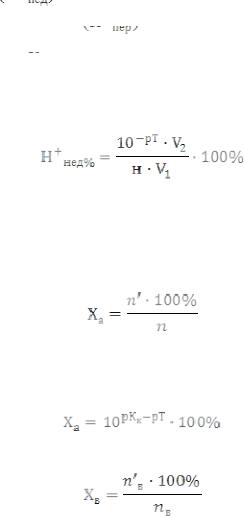
103

104

–
–
–
Условия проведения окислительно-восстановительного
титрования
Реакция должна протекать практически до конца. ОВ реакция идёт тем полнее, чем больше константа равновесия, которая определяется соотношением:
Если 

восстановителем окислителю. При значении K >> 108 реакция протекает не менее чем на 99,99 %. Реакция должна протекать быстро. Для ускорения реакции растворы иногда нагревают или проводят титрование в присутствии катализатора. Реакция должна протекать стехиометрически, побочные процессы должны быть исключены. Конечная точка титрования (КТТ) должна определяться точно и однозначно либо с индикаторами, либо без них. В ОВР титровании применяется прямое, обратное и заместительное титрование. Уравнение Нернста для обратимой Red-Ox системы, выражается уравнением:
аOкисл + nē ↔ bВосст
Величина ОВ потенциала (Е) определяется уравнением:
где Е – окислительно-восстановительный потенциал, В; Е0 – стандартный ОВ потенциал, В; R – универсальная газовая
105
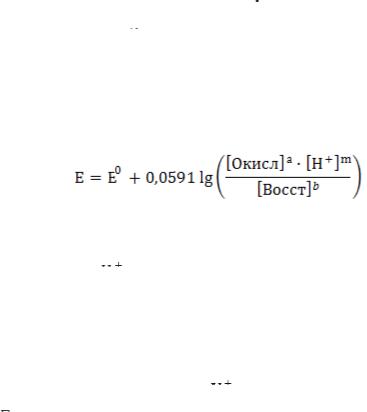
постоянная, равная 8,31 Дж/(моль град); Т – абсолютная температура, К; 
реакции; F – число Фарадея, равное 96485 Кл; [Окисл] – концентрация окисленной формы, моль/дм3; [Восст] – концентрация восстановленной формы, моль/дм3.
Если заменить константы их числовыми значениями и перейти от ln к lg, то при Т = 298 К (25 °С) уравнение примет вид:
Таким образом, потенциал ОВ системы зависит от природы реагирующих веществ (E0), температуры, концентрации окисленной и восстановленной форм, а также
концентрации 
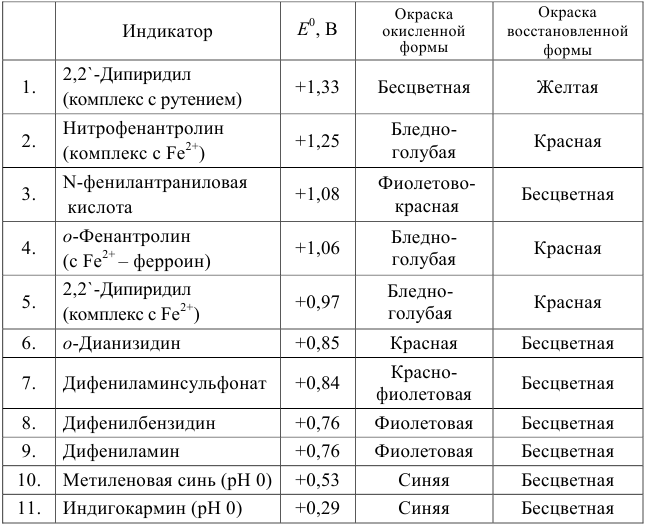
Значение стандартных ОВ потенциалов приведены в справочных таблицах. В табл. 17 приведены ОВ потенциалы некоторых систем.
Окислитель – вещество с большим значением E0. Меняя соотношение концентраций окисленной и восстановленной
форм, а также концентрацию 

Все методы окисления-восстановления основаны на окислительно-восстановительных реакциях между анализируемым веществом и титрантом. Названия частных окислительно-восстановительных методов происходит от наименований используемых титрантов. В перманганатометрии титрантом служит раствор перманганата калия KMnO4.
106
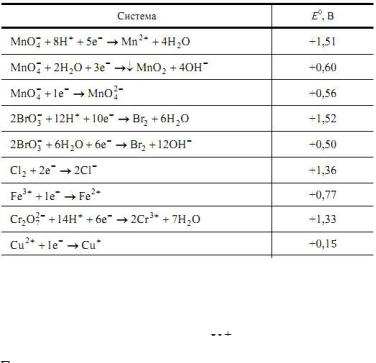
Таблица 17 Значения стандартных окислительно-восстановительных
систем
Окислитель – вещество с большим значением E0. Меняя соотношение концентраций окисленной и восстановленной
форм, а также концентрацию 

Все методы окисления-восстановления основаны на окислительно-восстановительных реакциях между анализируемым веществом и титрантом. Названия частных окислительно-восстановительных методов происходит от наименований используемых титрантов. В перманганатометрии титрантом служит раствор перманганата калия KMnO4, играющий в реакциях роль окислителя.
107
Поскольку при окислительно-восстановительных реакциях электроны переходят от одних атомов к другим, вычисляя эквивалентные массы окислителей и восстановителей, исходят из числа электронов, приобретаемых или теряемых в реакции молекулой вещества. При этом учитывают, что атом водорода отдает (Н0 – е → Н+).
При реакции в кислой среде каждая молекула KMnO4 приобретает пять электронов, которые могут быть присоединены пятью ионами Н+. Следовательно, в этой, реакции молярная масса KMnO4 равноценна пяти моль катионов Н+, а эквивалентная масса равна 1/5 молярной массы:


Чтобы найти эквивалентную массу окислителя, нужно его молярную массу разделить на число электронов n, приобретаемых одной молекулой в данной реакции: mэ = M/n.
Эквивалентные массы восстановителей находят делением молярной массы на число электронов (n), теряемых одной молекулой в реакции: mэ = М/n.
При перманганатометрическом титровании анализируемого раствора малино-фиолетовая окраска раствора KMnO4 обесцвечивается. В момент достижения точки эквивалентности, когда в растворе не остается восстановителя от прибавления одной капли KMnO4 титруемая смесь окрашивается в розовый цвет. Индикатором является раствор KMnO4. Окислительные свойства KMnO4 проявляются в кислой, щелочной среде. При титровании кислых растворов перманганат анион MnO4восстанавливается до бесцветных катионов Mn2+:
108
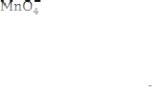
|
2KMnO4 |
+ 10FeSO4 + 8H2S04 = 5Fe2(SO4)3 + 2MnSO4 |
|
+ +K2SO4 + 8H2O |
|
|
2 │ 1 │ |
МnО4— + 8H+ +5e → Mn2++4H2O |
|
10│ 5 │ Fe2+— e →Fe3+ |
|
|
При титровании в щелочной или нейтральной среде |
|
|
анионы |
восстанавливаются только до катионов Мn4+: |
2KMnO4 + Cr2(SO4)3 + 8KOH = 2MnO2 + 2K2CrO4 + 3K2SO4 + +8H2O

Перманганатометрию чаще всего применяют для анализа солей Fe(II), Са(II), Cu(I), щавелевой кислоты, пероксида водорода.
В основе йодометрии лежат свойства йода и йодид анионов. Элементарный йод ведет себя в реакциях как окислитель: I2 + 2е = 2I-, а йодид-анионы I- отдают свои электроны веществам-окислителям и играют роль восстановителей: 2I- — 2е = I2. Прямое йодометрическое титрование восстановителей основано на их взаимодействии с раствором I2 в присутствии крахмала. Взаимодействие йода с Na2S203 проходит по уравнению:
2Na2S203 + I2 = 2NaI + Na2S406 1 │ 2S2032—2e = S4O62-;
1 │ I2 + 2е = 2I-.
Каждая молекула I2 окисляет два тиосульфат аниона до тетратионат аниона S4062- (тетратионовой кислоты H2S4O6). Сами же атомы I2 восстанавливаются до ионов I-. Точка эквивалентности фиксируется по неисчезающей синей окраске крахмала от одной избыточной капли I2.
С помощью раствора I2 определяют содержание других восстановителей: мышьяковистой, сернистой и сероводородной кислот, их солей, хлорида олова (II).
Определяя окислители, к анализируемому раствору прибавляют избыток йодида калия KI, из которого окислитель выделяет эквивалентное ему количество свободного I2.
109
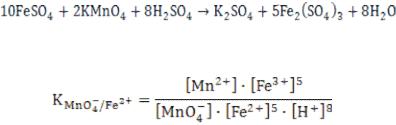
Последний йод оттитровывают раствором восстановителя, например, раствором Na2S203 в присутствии крахмала. Затем вычисляют количество окислителя (раствора КМn04), которое будет эквивалентно количеству Na2S203, пошедшего на титрование I2:
2KMnO4 + 10KI + 8H2SO4 = 5I2 + 2MnS04 + 6K2S04 + 8H2O;
|
5 |
│ 2 │ MnO4— |
+ 8H+ + 5е = Мn2+ + 4Н20; |
|
1 |
│10 │ 2I- — 2е = I2. |
|
|
Этим |
способом |
определяют и другие окислители: |
бихроматы, соли Cu(II), соли Fe(II), свободные галогены. Крахмал, используемый в йодометрии, – специфический
индикатор, образующий с I2 адсорбционное соединение синего цвета. Крахмал прибавляют в самом конце титрования, когда йода становится мало и титруемый бурый раствор становится бледно-желтым. После прибавления крахмала титруют раствор синего цвета до исчезновения окраски.
Кривые окислительно-восстановительного титрования по внешнему виду аналогичны кривым кислотно-основного титрования. Они выражают зависимость степени оттитрованности от потенциала окислительновосстановительной системы; вблизи точки эквивалентности происходит резкий скачок окислительно-восстановительного потенциала.
Константа равновесия окислительно-восстановительных
реакций
Рассмотрим реакцию:
+ 2 MnSO4
Рассчитаем:
110
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Подборка по базе: Дифференцированный зачет по химии.docx, весь Тесты для самоконтроля _ Интенсификация разработки и по.pdf, ответы на тесты Дифференциальная психология. Психология индивиду, 25.05 Э 211оз Тесты Региональная экономика.docx, Пед Тесты ИГА каз-1,2,3, тренир тесты.docx, Ответы на тесты Управление изменениями_1.docx, Все промежуточные тесты (1).docx, Психиатрия тесты.docx, Контрольная работа по химии.pdf, МӘМС тесты 1.docx
3.6.2. Кислотно-основное титрование.
60. В качестве первичных стандартных веществ в кислотно-основном титро- вании применяются:
1. уксусная кислота;
2. хлорид натрия;
3. бифталат калия;
4. щавелевая кислота.
Ответ: 3,4 – Бифталат калия, щавелевая кислота, бензойная кислота удовлетворяют основным требованиям, предъявляемым к первичным стан- дартным веществам. Эти вещества применяют при установлении точной концентрации растворов сильных оснований:
O
H
2
O
C
Na
NaOH
2
O
C
H
O
H
O
H
KNaC
NaOH
O
H
KHC
2 4
2 2
4 2
2 2
4 4
8 4
4 8
Растворы щелочей при хранении поглощают оксид углерода(II) из воздуха.
Поэтому растворы щелочей закрывают пробками, в которые вставлены спе- циальные поглотительные трубки с натронной известью или оксидом каль- ция. Рекомендуется хранить растворы щелочей в парафинированной или фторопластовой посуде, так как щелочи взаимодействуют со стеклом.
61. В качестве первичных стандартных веществ в кислотно-основном титро- вании применяют:
1. карбонат натрия;
2. хлорид калия;
3. эозин;
4. фенилкарбазид.
Ответ: 1 – Первичные стандартные вещества должны удовлетворять определенным требованиям (соответствие состава химической формуле, ус- тойчивость, большая молекулярная масса) В кислотно-основном тировании в качестве первичных стандартных растворов применяют карбонат натрия, тетраборат натрия, щавелевую кислоту и др.
62. К вторичным стандартным растворам в кислотно-основном титровании относятся:
1. раствор пероксида водорода;
2. раствор хлороводородной кислоты;
3. раствор гидроксида натрия;
4. раствор аммиака.
Ответ: 2,3 – Приготовленные растворы хлороводородной кислоты и гидроксида натрия являются вторичными стандартными растворами или рас- творами с установленным титром. Сначала готовят растворы этих веществ приблизительно нужной концентрации. Затем устанавливают концентрацию таких (рабочих) растворов с использованием первичных стандартных ве- ществ (исходные вещества). Концентрацию рабочих растворов иногда уста-
80 навливают по первичным стандартным веществам. Например, концентрацию раствора гидроксида натрия можно установить по раствору хлороводородной кислоты, концентрация которого установлена по буре.
63. В качестве рабочих растворов (титрантов) в методах кислотно-основного титрования применяют:
1. раствор серной кислоты;
2. раствор аммиака;
3. раствор гидроксида натрия;
4. раствор азотной кислоты.
Ответ: 1,3 – В качестве титрантов применяют растворы сильных кислот
(Н
2
SO
4
, HCI) и оснований (NaOH, KOH и др.). Раствор азотной кислоты не- устойчив при хранении. Растворы щелочей при хранении необходимо защи- щать от действия оксида углерода(II) из воздуха.
64. Первичными стандартными веществами для установления точной кон- центрации кислот являются:
1. декагидрат тетрабората натрия;
2. карбонат натрия;
3. раствор аммиака;
4. нет верного ответа.
Ответ: 1,2 – Первичное стандартное вещество должно удовлетворять следующим требованиям: быть химически чистым, состав вещества должен соответствовать формуле, вещество должно быть устойчиво при хранении; желательно, чтобы молярная масса эквивалента вещества была большой. Та- ким требованиям удовлетворяют карбонат натрия, бура и др.
NaCl
BO
H
O
H
HCl
NaBO
NaBO
2
BO
H
2
O
H
3
O
B
Na
NaCl
2
O
H
CO
HCl
2
CO
Na
3 3
2 2
2 3
3 2
7 4
2 2
2 3
2
65. При обнаружении точки эквивалентности в кислотно-основном титрова- нии применяют:
1. фенолфталеин;
2. хромат калия;
3. фенантролин;
4. метиловый оранжевый.
Ответ: 1,4 – В кислотно-основном титровании используют индикаторы, изменяющие свою окраску в зависимости от рН раствора. К таким индикато- рам относятся слабые органические кислоты и основания. Различают одно- цветные и двухцветные индикаторы. Например, фенолфталеин является од- ноцветным индикатором (в кислой среде – бесцветный, в щелочной — крас- ный). К двухцветным индикаторам относятся метиловый оранжевый, мети- ловый красный и др. В кислой среде метиловый оранжевый имеет красную окраску, а в щелочной — желтую.
81 66. Точку конца титрования в кислотно-основном титровании фиксируют:
1. безиндикаторным методом;
2. с применением индикаторов;
3. физико-химическим методом;
4. методом Мора.
Ответ: 2,3 – Реакции кислотно-основного взаимодействия не сопрово- ждаются видимыми изменениями, т.е. переменой окраски растворов. В каче- стве индикаторов в кислотно-основном титровании применяют слабые ки- слоты и основания, молекулярная или ионная формы которых имеют окра- ску. Кислотно-основные индикаторы бывают одноцветные, двухцветные, флуоресцентные. Фенолфталеин относится к одноцветным индикаторам (в щелочной среде приобретает красную окраску). Кислые растворы метилово- го оранжевого имеют красную окраску, а щелочные – желтую. К двухцвет- ным индикаторам относятся также метиловый красный, тропеолин О и дру- гие.
Для нахождения конечной точки титрования применяют также и физи- ко-химические методы (рН–метрия, кулонометрия). При кулонометрическом титровании определяемое вещество реагирует с титрантом, который получа- ется в результате электрохимической реакции на электроде. Электрогенери- рованные титранты можно получить из растворителя (при восстановлении воды на катоде получаются ОН
—
— ионы, а при окислении воды можно полу- чить H
+
— ионы).
67. В каких случаях точка эквивалентности совпадает с точкой нейтрально- сти?
1. титрование гидроксида натрия хлороводородной кислотой;
2. титрование серной кислоты гидроксидом натрия;
3. титрование уксусной кислоты гидроксидом натрия;
4. титрование карбоната натрия хлороводородной кислотой.
Ответ: 1,2 – Совпадение точки эквивалентности с точкой нейтрально- сти наблюдается при титровании сильных кислот сильными основаниями и наоборот. В точке эквивалентности среда нейтральная, рН=7.
68. Индикатором в кислотно-основном титровании может быть:
1. любое химическое вещество;
2. вещество, отвечающее определенным требованиям;
3. перманганат калия;
4. фенолфталеин.
Ответ: 2,4 – Индикаторы – это вещества, окраска которых изменяется в зависимости от изменения величины рН и не зависит от природы реагирую- щих между собой кислоты и основания. Кислотно-основными индикаторами могут быть вещества, отвечающие следующим требованиям: изменение ок- раски индикатора должно происходить в небольшом интервале рН, окраска индикатора должна быть интенсивной, окраска индикатора должна явно от-
82 личаться при близких значениях рН, т.е. высокая контрастность перехода ок- раски.
Фенолфталеин является примером одноцветного индикатора. В кислой среде фенолфталеин бесцветный (имеет структуру лактона). В щелочной среде образуется хиноидная структура (хромофор) и раствор приобретает красную окраску. В сильно щелочной среде (
рН 12) образуется бесцветное карбинольное основание.
69. Интервал перехода окраски кислотно-основного индикатора выражается уравнением:
1. рН=рК
а
1;
2. рН=рК
а
2;
3. рН=рК
н
1;
4. Е=рК
а
1;
Ответ: 1 – Из константы кислотности индикатора находим, что
[H
+
]=K
a
·c
k
/c
o и соответственно pH=pK
a
-lg(c
k
/c
o
). Принимая во внимание, что глаз воспринимает окраску той формы индикатора, концентрация которой в
10 раз больше, получаем рН=рК
а
1. Например, рК
а фенолфталеина равен 9 и соответственно интервал перехода окраски индикатора лежит между рН 8 и рН 10. У метилового оранжевого этот интервал уже (от 3,0 до 4,4). Это мож- но объяснить тем, что молярный коэффициент светопоглощения кислотной формы больше, чем основной формы.
Кислотно-основное титрование закачивают при значении рН, которое обозначают рТ (показатель титрования). Это значение рН лежит в середине интервала перехода и приблизительно соответствует рК
а индикатора.
70. Факторы, влияющие на показания кислотно-основных индикаторов:
1. температура;
2. буферная емкость раствора;
3. посторонние вещества;
4. нет верного ответа.
Ответ: 1, 3 – С изменением температуры изменяются величины кон- стант ионизации и соответственно изменяется интервал перехода окраски индикаторов. Например, при 18 0
С интервалы перехода метилового оранже- вого и фенолфталеина соответственно равны 3,1 — 4,4 и 8 – 10. При 100 0
С ин- тервалы перехода этих индикаторов приобретают другие значения: 2,5 – 3,7 и
8,1 – 9,0 соответственно.
Посторонние вещества, такие как органические растворители (этанол, ацетон) понижают ионизацию кислот и оснований, и, следовательно, влияют на интервалы перехода индикаторов. Оказывают влияние на интервал пере- хода индикаторов белковые вещества, электролиты. Поэтому при титровании учитывают «белковые» и «солевые» ошибки, титр рабочего раствора уста- навливают в тех же самых условиях.
83 71. Скачок рН на кривой титрования зависит от:
1. силы титруемой кислоты;
2. концентрации титранта;
3. рКа индикатора;
4. нет верного ответа.
Ответ: 1,2 – Величина скачка рН на кривой титрования зависит от си- лы титруемой кислоты или основания, концентраций титруемого вещества и титранта, температуры и других факторов. Чем сильнее титруемая кислота или основание, тем шире скачок рН на кривой титрования. При титровании
0,1 М раствора HCl 0,1 М раствором NaOH скачок рН на кривой титрования соответствует 6 единицам (от рН 4 до рН 10). В случае титрования 0,1 М рас- твора CH
3
COOH 0,1 М раствором NaOH резкое изменение рН происходит в области рН 7,76 – 10 (скачок рН на кривой титрования). Если же концентра- ции сильной титруемой кислоты и титранта (NaOH) равны 0,01 М, то скачок рН на кривой титрования меньше по величине и находится в пределах рН от
5 до 9.
72. Показатель титрования (рТ) – это:
1. рК
а
-1;
2. то значение рН, при котором заканчивают титрование с данным инди- катором;
3. рК
а
±1;
4. нет верного ответа.
Ответ: 2 – Значение рН, при котором заканчивают титрование с дан- ным индикатором, соответствует показателю титрования (рТ). Обычно пока- затель титрования находится в середине интервала перехода окраски индика- тора. Для метилового оранжевого рТ=4, для фенолфталеина – 9. Если показа- тель титрования индикатора лежит в пределах скачка титрования, то такой индикатор пригоден для титрования.
73. Скачок титрования на кривой кислотно-основного титрования – это:
1. появление окраски раствора;
2. исчезновение окраски раствора;
3. резкое изменение рН раствора;
4. нет верного ответа.
Ответ: 3 – Скачок титрования – это резкое изменение рН в области точки эквивалентности. По скачку титрования производится выбор индика- тора. Чем больше скачок титрования, тем большее число индикаторов можно использовать для определения точки конца титрования.
Величина скачка титрования зависит от концентрации реагентов (тит- руемое вещество и титрант). С уменьшением концентрации реагентов уменьшается и скачок титрования.
74. Растворитель, используемый в неводном титровании, должен:
1. иметь высокую диэлектрическую проницаемость;
84 2. растворять определяемое вещество;
3. не влиять на силу кислот и оснований;
4. нет верного ответа.
Ответ: 1,2 – Для титрования в неводных средах требуются раствори- тели, имеющие небольшую константу автопротолиза, высокую диэлектриче- скую проницаемость, хорошо растворяющие определяемые вещества. Таки- ми растворителями для титрования слабых кислот являются диметилформа- мид, пиридин и другие. Растворители с кислотными свойствами (безводная уксусная кислота, ацетонитрил) применяются для титрования слабых осно- ваний.
75. В качестве титрантов в неводных средах применяются:
1. гидроксид тетрабутиламмония;
2. хлорная кислота;
3. уксусная кислота;
4. диметилформамид.
Ответ: 1,2 – В неводных средах возможно определение нераствори- мых или разлагающихся в воде соединений, а также соединений, кислотные или основные свойства которых выражены очень слабо. Выбор неводного растворителя зависит от природы определяемого вещества, растворимости реагентов, возможности фиксирования точки эквивалентности и других фак- торов. Для титрования слабых кислот в качестве титрантов служат сильные основания, например, гидроксид тетрабутиламмония (С
4
H
9
)
4
NOH, метилат натрия в метаноле. В случае титрования слабых оснований в качестве тит- ранта применяют раствор хлорной кислоты в безводной уксусной кислоте.
Хлорная кислота в безводной уксусной кислоте применяется для титрования слабых оснований.
76. При титровании слабых оснований в неводных средах в качестве раство- рителей используют:
1. бензол;
2. безводную уксусную кислоту;
3. хлороформ;
4. нет верного ответа.
Ответ: 2 – В качестве растворителей при титровании слабых основа- ний в неводных средах используют растворители с кислотными свойствами
(безводная уксусная кислота).
77. Для титрования слабых кислот в неводных средах используют раствори- тели:
1. безводная уксусная кислота;
2. диметилформамид;
3. этанол;
4. нет верного ответа.
85
Ответ: 2 – При титровании слабых кислот в неводных растворителях рекомендуют основные растворители – диметилформамид, пиридин и др.
78. Методом кислотно-основного титрования борную и хлороводородную кислоты при совместном присутствии определяют:
1. с использованием двух титрантов;
2. с использованием метилового оранжевого и фенолфталеина;
3. по реакции образования борно-этилового эфира;
4. после переведения борной кислоты в глицероборную кислоту.
Ответ: 2,4 – Прямое титрование борной кислоты в водном растворе невозможно, так как борная кислота является слабой кислотой (рК
a
=9,24).
Вначале с метиловым оранжевым оттитровывают сильную (хлороводород- ную) кислоту, затем в раствор прибавляют глицерин (образуется глицеро- борная кислота), фенолфталеин и титруют раствором щелочи до появления оранжевой окраски. Объем щелочи, израсходованной на титрование с мети- ловым оранжевым, соответствует содержанию хлороводородной кислоты.
Расчет содержания борной кислоты проводят по объему щелочи, пошедшей на титрование с фенолфталеином.
79. Анализ смеси карбоната и гидроксида натрия проводят:
1. методом кислотно-основного титрования;
2. методом комплексонометрии;
3. с применением двух индикаторов (фенолфталеин и метиловый оранже- вый);
4. методом Мора.
Ответ: 1,3 – Методом кислотно-основного титрования определяют ки- слоты, основания и некоторые соли. Определение NaOH и Na
2
CO
3
при со- вместном присутствии проводят с применением двух индикаторов. При этом возможно определение двумя способами. В первом способе в присутствии фенолфталеина будет оттитрована щелочь и карбонат до гидрокарбоната. За- тем добавляют метиловый оранжевый и оттитровывают гидрокарбонат на- трия.
)
ин фенолфтале
(
O
H
H
OH
)
ин фенолфтале
(
HCO
H
CO
2 3
2 3
HCO
3
+H
+
→H
2
CO
3
CO
2
+H
2
O (метиловый оранжевый)
Во втором способе сначала исследуемый раствор титруют кислотой в при- сутствии метилового оранжевого. Затем во второй порции раствора ионы
2 3
СO осаждают ионами Ва
2+
и, не отфильтровывая осадок BaCO
3
, прибавля- ют фенолфталеин. Оттитровывают раствор до полного исчезновения красной окраски. Объем титранта, пошедший на титрование в присутствии фенолфта- леина, соответствует гидроксиду натрия. Объем кислоты, пошедший на тит- рование по метиловому оранжевому, был затрачен на титрование гидроксида и карбоната натрия. После осаждения карбонат-ионов титрование рекомен- дуется проводить с фенолфталеином, так как с метиловым оранжевым титро-
86 вание заканчивается в кислой среде и соответственно титрант (кислота) будет взаимодействовать не только с NaOH, но и будет расходоваться на растворе- ние BaCO
3
. При этом образуется СО
2 3
— ионы, вступающие в реакцию с ки- слотой.
80. Ацидиметрия относится к методам:
1. оксидиметрического титрования;
2. кислотно-основного титрования;
3. химического анализа;
4. нет верного ответа.
Ответ: 2,3 – Ацидиметрия – это метод кислотно-основного титрова- ния, в качестве титрантов используют сильные кислоты (HCl, H
2
SO
4
). Аци- диметрия относится к методам химического анализа и применяется для опре- деления оснований и некоторых солей (карбонаты, гидрокарбонаты).
NaCl
CO
H
HCl
NaHCO
NaCl
NaHCO
HCl
CO
Na
3 2
3 3
3 2
H
2
CO
3
CO
2
+H
2
O
81. В ацидиметрии в качестве титрантов используют:
1. H
2
SO
4
;
2. HCl;
3. CH
3
COOH;
4. NaOH.
Ответ: 1,2 – В качестве титрантов в ацидиметрии используют сильные кислоты (HCl, H
2
SO
4
). Эти кислоты не соответствуют требованиям, предъяв- ляемым к стандартным веществам. Поэтому после приготовления растворов
HCl и H
2
SO
4
проводят их стандартизацию. В качестве первичных стандартов используют буру Na
2
B
4
O
7
·10H
2
O, карбонат натрия Na
2
CO
3
и др.
Ацидиметрия применяется для определения сильных и слабых основа- ний, солей слабых кислот.
82. При стандартизации раствора HCl в качестве первичных стандартных ве- ществ используется:
1. декагидрат тетрабората натрия;
2. карбонат натрия;
3. раствор аммиака;
4. дифениламин.
Ответ: 1,2 – Хлороводородная кислота не относится к первичным стандартным веществам, так как не соответствует основным требованиям.
Приготовленный раствор HCl является вторичным стандартным раствором и его стандартизируют по первичным стандартам – декагидрат тетрабората на- трия Na
2
B
4
O
7
·10H
2
O, карбонат натрия Na
2
CO
3
и др.
HCl+Na
2
CO
3
→ NaHCO
3
+NaCl.
87 83. При титровании сильной кислоты сильным основанием возникают ошиб- ки:
1. водородная;
2. гидроксидная;
3. кислотная;
4. основная.
Ответ: 1,2 – Водородная ошибка возникает, если рТ<7. Такое явление наблюдается при титровании сильной кислоты щелочью, т.е. когда в растворе остается некоторое количество не оттитрованной сильной кислоты. При гид- роксидной ошибке рТ>7, т.е. в растворе имеется избыточное количество сильного основания по сравнению с точкой эквивалентности.
84. Кислотная ошибка обусловлена присутствием в растворе:
1. сильной кислоты;
2. сильного основания;
3. слабой кислоты;
4. нет верного ответа.
Ответ: 3 – Кислотная или НА–ошибка обусловлена присутствием в растворе некоторого количества неоттитрованной слабой кислоты и опреде- ляется отношением:
А
НА
, где [НА] – концентрация неоттитрованной кислоты;
[А
] – концентрация оттитрованной кислоты.
85. Азот в органических соединениях определяют:
1. методом Кьельдаля;
2. методом комплексонометрии;
3. гравиметрическим методом;
4. методом Фольгарда.
Ответ: 1 – В колбу Кьельдаля к анализируемой пробе прибавляют конц. серную кислоту, после разрушения органического вещества образуют- ся ионы аммония. Затем в колбу прибавляют гидроксид натрия и образую- щийся аммиак отгоняют в раствор борной или стандартный раствор серной
(хлороводородной) кислот. Образующиеся в первом случае борат-ионы от- титровывают раствором HCl. Во втором случае определяют избыток сильной кислоты (проводят обратное титрование).
86. К методам кислотно-основного титрования относят:
1. ацидиметрия;
2. алкалиметрия;
3. цериметрия;
4. хроматометрия.
Ответ: 1,2 – Методы кислотно-основного титрования классифицируют в зависимости от применяемого титранта (кислота или основание): в ациди-
88 метрии в качестве титранта применяют кислоту, в алкалиметрии титрантом является основание.
87.Кислотно-основные индикаторы проявляют свойства:
1.слабых кислот;
2.слабых оснований;
3.окислителей;
4.восстановителей.
Ответ: 1,2 – Кислотно-основные индикаторы проявляют свойства сла- бых кислот или слабых оснований.
HInd
O
H
2
Ind
O
H
3
кислотная форма щелочная форма
В кислых растворах доминирует кислотная форма, имеющая соответствую- щую окраску. В щелочных растворах доминируют частицы «Ind
—
», ответст- венные за окраску щелочной формы. При изменении рН окраска раствора изменяется. Обычно требуется 10-кратный избыток одной из форм, чтобы её окраска воспринималась наблюдателем. Исходя из уравнения Гендерсона-
Хассельбаха получаем, что рН
перехода
= рК
а
±1. Такая зависимость наблюдается только в том случае, если интенсивность окрасок обеих форм одинакова.
88. При определении азота в органических соединениях методом Кьельдаля используют:
1. концентрированную серную кислоту;
2. глюконат кальция;
3. сульфат меди(II);
4. сульфат калия.
Ответ: 1,3,4 – Разрушение (минерализацию) органических веществ проводят с применением концентрированной серной кислоты. Для повыше- ния температуры процесса окисления органических соединений применяют сульфат калия. Сульфат меди(II) используется в качестве катализатора. В ре- зультате минерализации получаются ионы аммония. При добавлении щелочи образующийся аммиак отгоняют в раствор борной или серной кислот. Затем проводят титрование борат-ионов раствором HCl или титруют раствором
NaOH избыток серной кислоты в зависимости от того, что использовали для поглощения аммиака.
89. По способности к взаимодействию с протоном неводные растворители делят на:
1. апротонные;
2. протолитические;
3. универсальные;
4. смешанные.
Ответ: 1, 2 – Неводные растворители классифицируют по способности взаимодействовать с протоном на апротонные и протонные (протолитиче- ские). Молекулы апротонных растворителей не ионизированы, не способны к
89 отщеплению или присоединению протонов. К таким растворителям относит- ся бензол. Кислоты и основания, растворенные в бензоле, не способны к дис- социации.
Молекулы протолитических растворителей могут присоединять или отщеплять протоны. По этому признаку растворители делятся на 3 группы: амфипротные (амфотерные), протофильные (основные), протогенные (ки- слотные).
Амфипротные (нейтральные) растворители приблизительно в одинако- вой степени способны присоединять и отщеплять протоны, т.е. являются ак- цепторами и донорами протонов. К таким растворителям относятся вода, спирты (метанол, этанол) и др.
Молекулы протофильных растворителей легко присоединяют протоны и соответственно повышают силу кислот. Например, такими растворителями являются пиридин, жидкий аммиак и др.
Молекулы протогенных растворителей легко отдают протоны (безвод- ные карбоновые кислоты – уксусная, муравьиная и др.).
Кислотная ошибка
Cтраница 2
Из приведенных примеров видно, что водородная функция стеклянного электрода нарушается в сильнощелочной и в сильнокислой области. Для большинства электродов в кислых растворах ошибка в измерении рН становится заметной только при рН 2 и достигает достаточно большой величины при рН, близких к нулю. Кислотная ошибка приводит к завышению результатов определения рН по сравнению с истинными. Ее природа до сих пор детально не выяснена. Одно из предположений состоит в том, что в кислой среде с высокой ионной силой активность воды по обеим сторонам стеклянной мембраны не остается одинаковой, и поэтому в воде возникает концентрационная ячейка, потенциал которой также входит в измеряемую разность потенциалов. Кислотные ошибки трудно устранить, но, к счастью, они невелики.
[16]
Следует иметь в виду, что определение рН с помощью индикаторов, которое вообще не является особенно точным ( до 0 1), в некоторых случаях становится еще менее точным в силу ряда ошибок, свойственных данному методу; наиболее важными из этих ошибок являются кислотная, солевая и белковая. Кислотная ошибка обусловлена тем, что сам индикатор, являющийся слабой кислотой или слабым бснованием, изменяет реакцию того раствора, к которому он добавлен. В растворах, обладающих буферными свойствами, кислотная ошибка не проявляется. Для уменьшения кислотной ошибки в небуферных растворах следует добавлять к ним возможно малые количества индикатора.
[17]
Характеристики электрода в значительной степени определяются природой стеклянной мембраны. Величина щелочной ошибки зависит от природы и концентрации ионов щелочных металлов, а также от температуры. На другом конце шкалы рН неправильные показания могут быть следствием кислотной ошибки.
[18]
Поскольку НА — кислота слабая, величина [ НА ] практически равна общей концентрации свободной кислоты в растворе, а величина [ А ] — концентрации соли. Но каждая грамм-молекула соли образуется в результате нейтрализации грамм-молекулы кислоты. Следовательно, отношение [ НА ]: [ А — ] можно рассматривать, как отношение концентраций неоттитрованной части кислоты к оттитрованной ее части и считать его мерилом величины кислотной ошибки титрования.
[19]
Уравнение (VI.67) строго справедливо для кислых, нейтральных и слабощелочных растворов. При больших рН наблюдаются отклонения от этого уравнения, значения которых зависят от сорта стекла, природы катионов раствора и рН среды. Эти отклонения называются щелочной ошибкой стеклянного электрода. Однако эта кислотная ошибка не зависит от природы анионов и катионов. Потенциал стеклянного электрода не искажается в присутствии каких-либо окислительно-восстановительных систем, в растворах солей тяжелых и благородных металлов, так называемых электродных ядов ( сернистых, мышьяковистых и других соединений), органических веществ. Стеклянный электрод можно применять в окрашенных и мутных растворах, в средах, не обладающих буферностью, вблизи точки нейтрализации, причем скорость установления ЕСт достаточно велика. Стеклянные микроэлектроды позволяют определить рН в небольших объемах жидкости и очень удобны для измерения рН в биологических объектах.
[20]
Следует иметь в виду, что определение рН с помощью индикаторов, которое вообще не является особенно точным ( до 0 1), в некоторых случаях становится еще менее точным в силу ряда ошибок, свойственных данному методу; наиболее важными из этих ошибок являются кислотная, солевая и белковая. Кислотная ошибка обусловлена тем, что сам индикатор, являющийся слабой кислотой или слабым бснованием, изменяет реакцию того раствора, к которому он добавлен. В растворах, обладающих буферными свойствами, кислотная ошибка не проявляется. Для уменьшения кислотной ошибки в небуферных растворах следует добавлять к ним возможно малые количества индикатора.
[21]
Измеряя рН с индикатором, следует учитывать ошибки, зависящие от его природы. В присутствии нейтральных солей возникает солевая ошибка. Нейтральные соли смещают равновесие между диссоциированной и недиссоциированной формами индикатора, поскольку меняется активность его ионов при изменении ионной силы раствора. В присутствии белков, алкалоидов, в коллоидных растворах возникают белковая, алкалоидная и другие ошибки из-за адсорбции ими индикатора и изменения его окраски. В небуферных растворах возможна кислотная ошибка, так как при диссоциации индикатора изменяется рН испытуемого раствора. В таких случаях индикатор предварительно нейтрализуют. Отдельный индикатор практически может быть использован лишь в пределах своей зоны перехода.
[22]
Из приведенных примеров видно, что водородная функция стеклянного электрода нарушается в сильнощелочной и в сильнокислой области. Для большинства электродов в кислых растворах ошибка в измерении рН становится заметной только при рН 2 и достигает достаточно большой величины при рН, близких к нулю. Кислотная ошибка приводит к завышению результатов определения рН по сравнению с истинными. Ее природа до сих пор детально не выяснена. Одно из предположений состоит в том, что в кислой среде с высокой ионной силой активность воды по обеим сторонам стеклянной мембраны не остается одинаковой, и поэтому в воде возникает концентрационная ячейка, потенциал которой также входит в измеряемую разность потенциалов. Кислотные ошибки трудно устранить, но, к счастью, они невелики.
[23]
Выше было показано, что рТ индикатора, отвечающий точке конца титрова-ия, как правило, не совпадает с рН раствора в точке эквивалентности. Это вызывает индикаторную ошибку титрования. Вследствие несовпадения рТ выбранного индикатора и рН титруемого раствора в точке эквивалентности раствор обычно либо несколько перетитровывают, либо, наоборот, недотитровывают. В результате по окончании титрования раствор содержит некоторый избыток свободной кислоты или свободной щелочи. Если значение рТ меньше чем рН в точке эквивалентности, то ошибка вызывается избытком Н — иона и называется водородной ошибкой Н — ошибкой. Если, наоборот, рТ больше, чем в точке эквивалентности, то ошибка вызвана избытком ОН — — ионов и называется гидр-оксильной ошибкой ОН — — ошибкой. Если титруют не сильные, а слабые кислоты и основания, когда кислота или основание присутствуют практически в неионизированной форме, то говорят о кислотной ошибке, или HAn-ошибке, соответственно — об основной ошибке, или МеОН — ошибке. При титровании щелочей или слабых оснований знаки у Н — ошибки ( и НАп-ошибки) ОН — — ошибки ( МеОН — ошибки), естественно, меняются на обратные.
[24]
Страницы:
1
2
Расчет индикаторных погрешностей кислотно-основного титрования
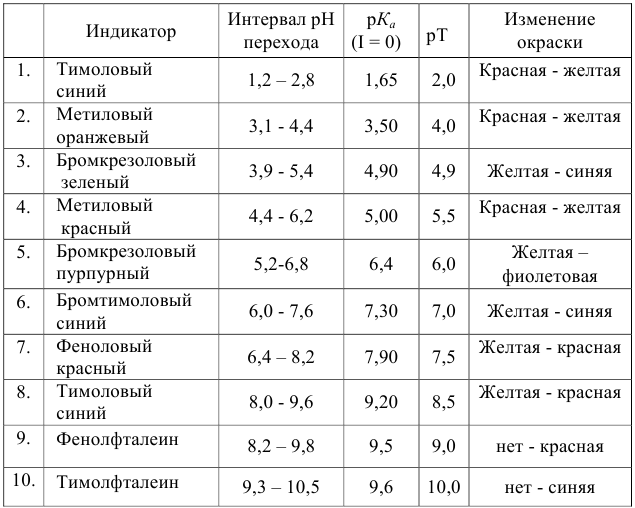
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 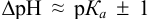
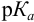
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 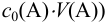
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
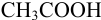
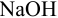
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
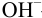
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 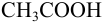



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 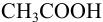
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 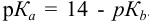
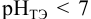
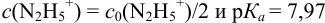
Сравнивая рТ индикаторов и 
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 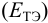

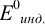
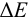
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 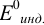
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 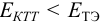
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 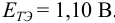
Выберем для рассмотрения порядка расчета два индикатора:
а) с 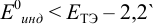
б) с 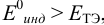
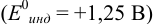
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
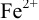



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

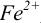
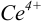
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 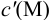
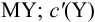
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 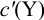
Вблизи ТЭ 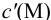
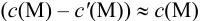
следовательно:
Выражение (8.21) тождественно выражению: 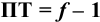
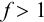
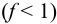
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
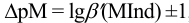
Интервал перехода окраски 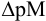
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 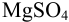

Решение:
В данных условиях 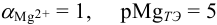
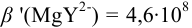
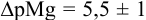
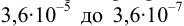

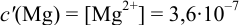
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 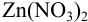

Решение:
1. Рассчитаем условную константу 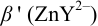
Общие константы устойчивости для аммиачных комплексов 
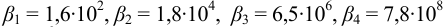

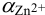
По табл. 7 и табл. 4 приложения находим 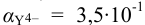
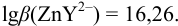

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 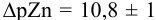
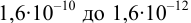

2. Конечная точка титрования наступает при [
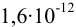

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Кислотная ошибка титрования. Предположим, чтс для титрования дана слабая кислота НАп с / нап=Ю , Р/ нап=5. Титрование ведут в присутствии индикатора с рТ = 10. В этом случае [c.114]
Кислотная ошибка титрования — ошибка, вызываемая присутствием в титруемом растворе по окончании титрования нейтральных молекул недотитрованной слабой кислоты. См. Водородная ошибка, Гидро-ксильная ошибка. [c.147]
Кислотная ошибка титрования. Для вычисления кислотной ошибки тит -рования, т. е. погрешности, обусловленной присутствием при окончании титрования недиссоциированных молекул неоттитрованной слабой кислоты (НА) в растворе, напишем прежде всего уравнение константы диссоциации последней [c.295]
Значит, в тех случаях, когда применение данного индикатора вызывает возникновение кислотной ошибки титрования, он пригоден только при условии, если величина показателя титрования индикатора рТ не жнее чем на [c.296]
Кислотная ошибка титрования. Предположим, что для ти- [c.140]
Кислотная ошибка титрования обусловливается наличием в растворе нейтральных молекул слабой кислоты. [c.328]
Кислотная ошибка титрования. Вычислим кислотную ошибку титрования, т. е. погрешность, вызванную наличием недиссоциированных молекул слабой кислоты в конце титрования (НАп). [c.330]
Значит, в тех случаях, когда применение данного индикатора вызывает возникновение кислотной ошибки титрования, он пригоден только при условии, если величина показателя титрования индикатора рТ не менее чем на 3 превышает величину силового показателя кислоты К- [c.291]
Преобразуем уравнение константы диссоциации слабой кислоты, обусловливающей кислотную ошибку титрования, [c.72]
Поскольку НАп — кислота слабая и в присутствии соли, образовавшейся при ее титровании, практически неионизированная, величина [НАп] равна общей коицеичрации свободной кислоты в растворе, а величина Ап ] — концентрации соли. Но каждая грамм-молекула соли образуется в результате нейтрализации грамм-молекулы кислоты. Следовательно, отношение [НАп] [Ап ] можно рассматривать как отношение концентрации неоттитрованной части кислоты к оттитрованной ее части и считать его мерилом величины кислотной ошибки титрования. Заметим далее, что [Н+] = Ю , а /(нап = 10-г , из приведенного выше уравнения находим [c.288]
Таким образом, когда применение данного индикатора вызывает возникновение кислотной ошибки титрования, он пригоден только прп условии, если величина показателя титрования индикатора рТ не менее чем на 3 единицы превышает величину показателя кислоты рЛ. Например, можно сказать заранее, что дост аточно точно оттитровывать уксусную кислоту (рК = 4,76) можно только при использовании таких индикаторов, показатель титрования которых рТ 7,76, т. е. ни метиловый оранжевый (рТ = 4), ни метиловый красный (рТ = 5,5), пи даже лакмус (рТ = 7) для данного титрования непригодны. Наоборот, фенолфталеин (рТ = 9) должен оказаться пригодным. [c.288]
Решение. В точке эквивалентности pH раствора равен 8,22 (см. табл. 7.18). Титрование с метиловым оранжевым заканчивается при pH 4 (см. табл. 7.13), т. е. до точки эквивалентности. Следовательно, в растворе присутствуют недотит-рованные молекулы НСООН и будет иметь место кислотная ошибка титрования. По формуле табл. 7.19 вычисляют ошибку [c.172]
Основы аналитической химии Часть 2 (1965) — [
c.111
,
c.114
]
Химия Краткий словарь (2002) — [
c.146
]
Основы аналитической химии Книга 2 (1961) — [
c.140
]
Основы аналитической химии Издание 3 (1971) — [
c.154
,
c.156
]
Основы аналитической химии Кн 2 (1965) — [
c.111
,
c.114
]

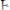


















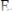









































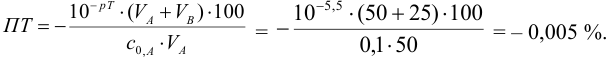
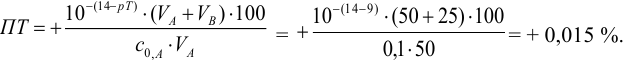
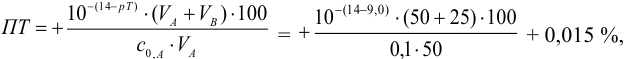
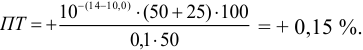
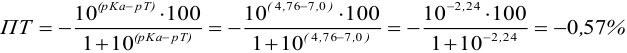
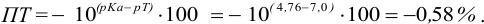
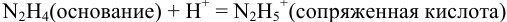
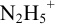
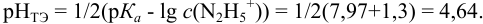
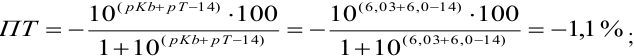
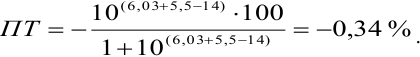

 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.