Репарация ошибочно спаренных нуклеотидов
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 февраля 2022 года; проверки требует 1 правка.
Репарация ошибочно спаренных нуклеотидов — система обнаружения и репарации вставок, пропусков и ошибочных спариваний нуклеотидов, возникающих в процессе репликации и рекомбинации ДНК, а также в результате некоторых типов повреждений ДНК[1][2].
Сам факт ошибочного спаривания не позволяет исправить ошибку, поскольку она может находиться на любой из двух составляющих ДНК ниток. Однако ошибки спаривания, как правило, локализуются только на одной (дочерней) нити ДНК, что позволяет избежать неоднозначности в интерпретации ошибки. В грам-положительных бактериях исходная нитка ДНК метилирована, а дочерняя нитка некоторое время остаётся неметилированной. Механизм распознавания исходной и дочерней ниток у других прокариот и эукариот в настоящее время неясен[3]. Предполагается, что у них дочерняя нить ДНК содержит разрезы, которые затем удаляются ДНК-лигазой.
Вероятность ошибки при репликации ДНК составляет 10–7—10–8. Система репарации ошибочно спаренных нуклеотидов снижает эту вероятность до 10–9[4].
Процесс репарации заключается в распознавании дефекта, определении исходной и дочерней нити ДНК, удалении ошибочно включённого нуклеотида и его замена правильным нуклеотидом. Удаляется обычно не только неправильный нуклеотид, но и часть нити ДНК вокруг него, после чего дочерняя нить восстанавливается, используя основную нить как матрицу[5].
Белки-репараторыПравить
Репарация ошибочно спаренных нуклеотидов — чрезвычайно консервативный процесс, практически без изменений унаследованный эукариотами от прокариот. Впервые этот тип репарации был обнаружен у S. pneumoniae (гены HexA и HexB). В дальнейшем исследования E. coli позволили обнаружить ряд генов, блокировка которых вызывает резкое повышение уровня мутаций. Белки, кодируемые этими генами, являются главными активными составляющими системы репарации и обозначаются префиксом «Mut»: MutS, MutH и MutL (MutS и MutL являются гомологами HexA и HexB соответственно).
MutS формирует димер (MutS2), который распознаёт неправильный нуклеотид на дочерней нити ДНК и связывается с дефектным участком ДНК. MutH связывается с полуметилированным участком ДНК, однако не совершает никаких действий, пока не будет активирован димером MutL (MutL2), который служит медиатором между MutS2 и MutH, активируя последний. Спираль ДНК расплетается в поисках ближайшей к дефекту метилированной группы GATC, которая может находиться на расстоянии 1000 нуклеотидов и более. MutH разрезает дочернюю нитку ДНК вблизи метилированной группы и активирует одну из хеликаз UvrABC, которая отделяет дочернюю нить от основной и отрезает её в районе дефекта, включая сам дефект и ближайшие к нему нуклеотиды. Используемая эндонуклеаза зависит от того, по какую сторону (3′ или 5′) от дефекта MutH разрезает нитку ДНК. Если разрез сделан на стороне 5′, используется RecJ или ExoVII, если на стороне 3′, то ExoI. Образовавшийся однониточный участок заполняется ДНК-полимеразой III, которая использует основную нитку в качестве образца, а затем разорванная нитка ДНК сшивается ДНК-лигазой и метилируется метилазой[5].
Гомологи MutSПравить
Связываясь с ДНК, MutS2 деформирует спираль и покрывает около 20 нуклеотидных пар. Он обладает слабыми аденозинтрифосфатазными свойствами и связывая АТФ формирует третичную структуру молекулы. Рентгеноструктурный анализ показывает, что структура молекулы MutS исключительно асимметричная, и хотя активной конфигурацией является димер, только один из мономеров взаимодействует с дефектным участком ДНК.
У эукариот в качестве гомологов MutS обнаружены два гетеродимера: Msh2/Msh6 (MutSα) и Msh2/Msh3 (MutSβ). MutSα используется для репарации нуклеотидных замен и небольших петель, возникших в результате вставки или делеции нуклеотидных цепочек. MutSβ удаляет только длинные петли (10 и более нуклеотидов)[6].
Гомологи MutLПравить
MutL также обладает слабыми аденозинтрифосфатазными свойствами (использует АТФ для движения вдоль нитки ДНК). Он образует с MutS и MutH комплекс, расширяя участок взаимодействия MutS с ДНК.
ПримечанияПравить
- ↑ Iyer R., Pluciennik A., Burdett V., Modrich P. DNA mismatch repair: functions and mechanisms (англ.) // Chem Rev (англ.) (рус. : journal. — 2006. — Vol. 106, no. 2. — P. 302—323. — doi:10.1021/cr0404794. — PMID 16464007.
- ↑ Larrea A. A., Lujan S. A., Kunkel T. A. DNA mismatch repair (англ.) // Cell. — Cell Press, 2010. — Vol. 141, no. 4. — P. 730. — doi:10.1016/j.cell.2010.05.002. — PMID 20478261.
- ↑ Modrich Paul. Strand-specific Mismatch Repair in Mammalian Cells (англ.) // Journal of Biological Chemistry. — 1997. — 3 October (vol. 272, no. 40). — P. 24727—24730. — ISSN 0021-9258. — doi:10.1074/jbc.272.40.24727. — PMID 9312062. [исправить]
- ↑
James A. Shapiro Evolution: A View from the 21st Century . FT Press Science, 2011, 254 р., ISBN 978-0-13-278093-3. - ↑ 1 2 Cline Susan D., Hanawalt Philip C. Who’s on first in the cellular response to DNA damage? (англ.) // Nature Reviews Molecular Cell Biology. — 2003. — May (vol. 4, no. 5). — P. 361—373. — ISSN 1471-0072. — doi:10.1038/nrm1101. — PMID 12728270. [исправить]
- ↑ MARRA Giancarlo, SCHÄR Primo. Recognition of DNA alterations by the mismatch repair system (англ.) // Biochemical Journal. — 1999. — 15 February (vol. 338, no. 1). — P. 1. — ISSN 0264-6021. — doi:10.1042/0264-6021:3380001. — PMID 9931291. [исправить]
См. такжеПравить
- en:Base excision repair
- Эксцизионная репарация нуклеотидов
СсылкиПравить
- Sung-Hoon Jun, Tae Gyun Kim, Changill Ban DNA mismatch repair system. Classical and fresh roles. FEBS Journal 273 (2006) 1609–1619, doi:10.1111/j.1742-4658.2006.05190.x.
- DNA Repair Архивная копия от 12 февраля 2018 на Wayback Machine
- MeSH DNA+Mismatch+Repair
- Hsieh P., Yamane K. DNA mismatch repair: Molecular mechanism, cancer, and ageing (англ.) // Mech Ageing Dev : journal. — 2008. — Vol. 129, no. 7—8. — P. 391—407. — doi:10.1016/j.mad.2008.02.012. — PMID 18406444. — PMC 2574955.
- Iyer R., Pluciennik A., Burdett V., Modrich P. DNA mismatch repair: functions and mechanisms (англ.) // Chem Rev (англ.) (рус. : journal. — 2006. — Vol. 106, no. 2. — P. 302—323. — doi:10.1021/cr0404794. — PMID 16464007.
- Joseph N., Duppatla V., Rao D. N. Prokaryotic DNA mismatch repair (неопр.) // Prog. Nucleic Acid Res. Mol. Biol.. — 2006. — Т. 81. — С. 1—49. — doi:10.1016/S0079-6603(06)81001-9. — PMID 16891168.
- Yang W. Structure and function of mismatch repair proteins (неопр.) // Mutation Research (англ.) (рус.. — Elsevier, 2000. — Т. 460, № 3—4. — С. 245—256. — PMID 10946232.
- Griffith, Wessler, Lewontin, Gelbart, Suzuki, Miller, Introduction to Genetic Analysis, 8th Edition, W.H. Freeman and Company, ISBN 0-7167-4939-4
- Thomas A.Kunkel and Dorothy A. Erie,(2005), DNA Mismatch Repair, Annu Rev.Biochem,74:681-710
- Errol C.Friedberg, Graham C. Walker, Wolfram Siede, Richard D. Wood, Roger A. Schultz, Tom Ellenberger, DNA repair and Mutagenesis, 2nd edition, ASM press, ISBN 1-55581-319-4
- Репарация ошибочно спаренных нуклеотидов (mismatch repair) на сайте «Биология человека».
- MutL белок на сайте «Биология человека».
- Глазер В.М. Конверсия гена на сайте «Научная сеть».
- Репарация на сайте «Химическая энциклопедия».
- Hsieh, P. Molecular mechanisms of DNA mismatch repair. Mutat. Res. 486, 71–87 (2001).
Нескорректированные
изменения химической структуры генов,
воспроизводимые в последовательных
циклах репликации и проявляющиеся у
потомства в виде новых вариантов
признаков, называют генными
мутациями.
Изменения
структуры ДНК, образующей ген, можно
разделить на три группы. Мутации первой
группы заключаются в замене одних
оснований другими. Они составляют около
20% спонтанно
возникающих генных изменений. Вторая
группа мутаций обусловлена сдвигом
рамки считывания, происходящим при
изменении количества нуклеотидных пар
в составе гена. Наконец, третью группу
представляют мутации, связанные с
изменением порядка нуклеотидных
последовательностей в пределах гена
(инверсии).
Мутации
по типу замены азотистых оснований.
Эти мутации происходят в силу ряда
конкретных причин. Одной из них может
быть возникающее случайно или под
влиянием конкретных химических агентов
изменение структуры основания, уже
включенного в спираль ДНК. Если такая
измененная форма основания остается
не замеченной ферментами репарации, то
при ближайшем цикле репликации она
может присоединять к себе другой
нуклеотид. Примером может служить
дезаминирование цитозина, превращающегося
в урацил самопроизвольно или под влиянием
азотистой кислоты (рис.
3.18). Образующийся
при этом урацил, не замеченный ферментом
ДНК-гликозилазой, при репликации
соединяется с аденином, который
впоследствии присоединяет тимидиловый
нуклеотид. В результате пара Ц—Г
замещается в ДНК парой Т—А
(рис.
3.19, I).
Дезаминирование метилированного
цитозина превращает его в тимин (см.
рис.
3.18). Тимидиловый
нуклеотид, являясь естественным
компонентом ДНК, не обнаруживается
ферментами репарации как изменение и
при следующей репликации присоединяет
адениловый нуклеотид. В результате
вместо пары Ц—Г
в молекуле ДНК также появляется пара
Т—А (рис.
3.19, II).
Рис.
3.18. Спонтанное
дезаминирование цитозина
Другой
причиной замены оснований может быть
ошибочное включение в синтезируемую
цепь ДНК нуклеотида, несущего химически
измененную форму основания или его
аналог. Если эта ошибка остается не
замеченной ферментами репликации и
репарации, измененное основание
включается в процесс репликации, что
нередко приводит к замене одной пары
на другую. Примером этого может служить
присоединение в ходе репликации к
аденину материнской цепи нуклеотида с
5-бромурацилом (5-БУ), аналогичного
тимидиловому нуклеотиду. При последующей
репликации 5-БУ охотнее присоединяет к
себе не аденин, а гуанин. Гуанин в ходе
дальнейшего удвоения образует
комплементарную пару с цитозином. В
итоге пара А—Т
заменяется в молекуле ДНК парой Г—Ц
(рис.
3.20).
Рис.
3. 19. Мутации
по типу замены основания
(дезаминирование
азотистых оснований в цепи ДНК):
I
—
превращение
цитозина в урацил, замена Ц—Г-пары
на Т—А-пару;
II
— превращение
метил—цитозина
в тимин, замена Ц—Г-пары
на Т—А-пару
Из приведенных
примеров видно, что изменения структуры
молекулы ДНК по типу замены оснований
возникают либо до, либо в процессе
репликации первоначально в одной
полинуклеотидной цепи. Если такие
изменения не исправляются в ходе
репарации, то при последующей репликации
они становятся достоянием обеих цепей
ДНК.
Рис.
3.20. Мутации
по типу замены оснований
(включение аналога
азотистого основания при репликации
ДНК)
Следствием замены
одной пары комплементарных нуклеотидов
на другую является образование нового
триплета в нуклеотидной последовательности
ДНК, кодирующей последовательность
аминокислот в пептидной цепи. Это может
и не отразиться на структуре пептида в
том случае, если новый триплет будет
«синонимом» прежнего, т.е. будет кодировать
ту же аминокислоту. Например, аминокислота
валин шифруется четырьмя триплетами:
ЦАА, ЦАГ, ЦАТ, ЦАЦ. Замена третьего
основания в любом из этих триплетов не
изменит его смысла (вырожденность
генетического кода).
В
том случае, когда вновь возникший триплет
шифрует другую аминокислоту, изменяются
структура пептидной цепи и свойства
соответствующего белка. В зависимости
от характера и места случившейся замены
специфические свойства белка изменяются
в разной
степени.
Известны случаи, когда замена лишь одной
аминокислоты в пептиде существенно
влияет на свойства белка, что проявляется
в изменении более сложных признаков.
Примером может служить изменение свойств
гемоглобина человека при серповидно-клеточной
анемии (рис.
3.21). В таком
гемоглобине—(HbS)
(в отличие от нормального НbА)
— в
р-глобиновых цепях в шестом положении
глутаминовая кислота заменена валином.
Это является следствием замены одного
из оснований в триплете, шифрующем
глутаминовую кислоту (ЦТТ или ЦТЦ). В
результате появляется триплет, шифрующий
валин (ЦАТ или ЦАЦ). В данном случае
замена одной аминокислоты в пептиде
существенно изменяет свойства глобина,
входящего в состав гемоглобина (снижается
его способность связываться с
02), у человека
развиваются признаки серповидно-клеточной
анемии.
В
некоторых случаях замена одного основания
на другое может привести к появлению
одного из нонсенс-триплетов (АТТ, АТЦ,
АЦТ), не шифрующего никакой аминокислоты.
Последствием такой замены будет
прерывание синтеза пептидной цепи.
Подсчитано, что замены нуклеотидов в
одном триплете приводят в
25% случаев
к образованию триплетов-синонимов; в
2—3 —бессмысленных
триплетов, в
70— 75% —к
возникновению истинных генных мутаций.
Таким образом,
мутации по типу замены оснований могут
возникать как в результате спонтанных
изменений структуры основания в одной
из цепей уже существующей двойной
спирали ДНК, так и в ходе репликации во
вновь синтезируемой цепи. В том случае,
если эти изменения не исправляются в
процессе репарации (или, наоборот,
возникают в ходе репарации), они
фиксируются в обеих цепях и далее будут
воспроизводиться в следующих циклах
репликации. Следовательно, важным
источником возникновения таких мутаций
являются нарушения процессов репликации
и репарации.
Мутации
со сдвигом рамки считывания.
Этот тип мутаций составляет значительную
долю спонтанных мутаций. Они происходят
вследствие выпадения или вставки в
нуклеотидную последовательность ДНК
одной или нескольких пар комплементарных
нуклеотидов. Большая часть изученных
мутаций, вызывающих сдвиг рамки,
обнаружена в последовательностях,
состоящих из одинаковых нуклеотидов.
Изменению
числа нуклеотидных пар в цепи ДНК
способствуют воздействия на генетический
материал некоторых химических веществ,
например акридиновых соединений.
Деформируя структуру двойной спирали
ДНК, они приводят к вставке дополнительных
оснований или их выпадению при репликации.
Примером служат мутации, полученные у
фага Т4 при воздействии профлавина. Они
состоят во включении или удалении всего
одной нуклеотидной пары. Важной причиной
изменения количества нуклеотидных пар
в гене по типу крупных делений (выпадений)
может быть рентгеновское облучение. У
плодовой мухи, например, известна мутация
гена, контролирующего окраску глаза,
которая вызывается облучением и состоит
в делении порядка 100
нуклеотидных пар.
Рис.
3.21.
Плейотропный эффект замены одной
аминокислоты в β-цепи гемоглобина
человека, приводящей к развитию
серповидно-клеточной анемии
Большое
число мутаций по типу вставок происходит
вследствие включения в последовательность
нуклеотидов подвижных генетических
элементов
—
транспозонов.
Транспозоны
—
это
достаточно протяженные нуклеотидные
последовательности, встроенные в геномы
эу-
и
прокариотических клеток, способные
самопроизвольно менять свое положение
(см. разд.
3.6.4.3). С
определенной вероятностью вставки и
делении могут возникать в результате
ошибок рекомбинации при неравноценном
внутригенном кроссинговере (рис.
3.22).
Рис.
3.22. Мутации
со сдвигом рамки считывания (неравноценный
обмен при внутригенном кроссинговере):
I
— разрывы
аллельпых генов в разных участках и
обмен фрагментами между ними;
II
— выпадение
3-й и 4-й пар нуклеотидов, сдвиг рамки
считывания;
III
—удвоение
3-й и 4-й пар нуклеотидов, сдвиг рамки
считывания
Рис.
3.23. Следствие
изменения количества нуклеотидных пар
в молекуле ДНК
Сдвиг рамки
считывания в результате вставки одного
нуклеотида в кодогенную цепь приводит
к изменению состава зашифрованного в
ней пептида
При
непрерывности считывания и неперекрываемости
генетического кода изменение количества
нуклеотидов, как правило, приводит к
сдвигу рамки считывания и изменению
смысла биологической информации,
записанной в данной последовательности
ДНК (рис.
3.23). Однако,
если количество вставленных или
утраченных нуклеотидов кратно трем,
сдвига рамки может не произойти, но это
приведет к включению дополнительных
аминокислот или выпадению части их из
полипептидной цепи. Возможным следствием
сдвига рамки является возникновение
нонсенс-триплетов, ведущее к синтезу
укороченных пептидных цепей.
Мутации
по типу инверсии нуклеотидных
последовательностей в гене.
Данный тип мутаций происходит вследствие
поворота участка ДНК на
180°. Обычно
этому предшествует образование молекулой
ДНК петли, в пределах которой репликация
идет в направлении, обратном правильному.
В пределах
инвертированного участка нарушается
считывание информации, в результате
изменяется аминокислотная последовательность
белка.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Обновлено: 11.06.2023
Существует несколько классификаций мутаций по различным критериям. Мёллер предложил делить мутации по характеру изменения функционирования гена на гипоморфные (измененные аллели действуют в том же направлении, что и аллели дикого типа; синтезируется лишь меньше белкового продукта), аморфные (мутация выглядит, как полная потеря функции гена, например, мутация white у Drosophila), антиморфные (мутантный признак изменяется, например, окраска зерна кукурузы меняется с пурпурной на бурую) и неоморфные.
В современной учебной литературе используется и более формальная классификация, основанная на характере изменения структуры отдельных генов, хромосом и генома в целом.
В рамках этой классификации различают следующие виды мутаций:
геномные;
хромосомные;
генные.
Геномные: — полиплоидизация (образование организмов или клеток, геном которых представлен более чем двумя (3n, 4n, 6n и т. д.) наборами хромосом) и анеуплоидия (гетероплоидия) — изменение числа хромосом, не кратное гаплоидному набору (см. Инге-Вечтомов, 1989). В зависимости от происхождения хромосомных наборов среди полиплоидов различают аллополиплоидов, у которых имеются наборы хромосом, полученные при гибридизации от разных видов, и аутополиплоидов, у которых происходит увеличение числа наборов хромосом собственного генома, кратное n.
При хромосомных мутациях происходят крупные перестройки структуры отдельных хромосом. В этом случае наблюдаются потеря (делеция) или удвоение части (дупликация) генетического материала одной или нескольких хромосом, изменение ориентации сегментов хромосом в отдельных хромосомах (инверсия), а также перенос части генетического материала с одной хромосомы на другую (транслокация) (крайний случай — объединение целых хромосом, т. н. Робертсоновская транслокация, которая является переходным вариантом от хромосомной мутации к геномной).
На генном уровне изменения первичной структуры ДНК генов под действием мутаций менее значительны, чем при хромосомных мутациях, однако генные мутации встречаются более часто. В результате генных мутаций происходят замены, делеции и вставки одного или нескольких нуклеотидов, транслокации, дупликации и инверсии различных частей гена. В том случае, когда под действием мутации изменяется лишь один нуклеотид, говорят о точечных мутациях.
Точечная мутация, или единственная замена оснований, — тип мутации в ДНК или РНК, для которой характерна замена одного азотистого основания другим. Термин также применяется и в отношении парных замен нуклеотидов. Термин точечная мутация включает так же инсерции и делеции одного или нескольких нуклеотидов. Выделяют несколько типов точечных мутаций.
Точечные мутации замены оснований. Поскольку в состав ДНК входят азотистые основания только двух типов — пурины и пиримидины, все точечные мутации с заменой оснований разделяют на два класса: транзиции и трансверсии
Транзиция — это мутация замены оснований, когда одно пуриновое основание замещается на другое пуриновое основание (аденин на гуанин или наоборот), либо пиримидиновое основание на другое пиримидиновое основание (тимин на цитозин или наоборот. Трансверсия — это мутация замены оснований, когда одно пуриновое основание замещается на пиримидиновое основание или наоборот).
Транзиции происходят чаще, чем трансверсии.
Точечные мутации сдвига рамки чтения. Они делятся на делеции и инсерции
Делеции — это мутация сдвига рамки чтения, когда в молекуле ДНК выпадает один или несколько нуклеотидов. Инсерция — это мутация сдвига рамки чтения, когда в молекулу ДНК встраивается один или несколько нуклеотидов.
Встречаются также сложные мутации. Это такие изменения ДНК, когда один её участок заменяется участком другой длины и другого нуклеотидного состава.
Точечные мутации могут появляться напротив таких повреждений молекулы ДНК, которые способны останавливать синтез ДНК. Например, напротив циклобутановых пиримидиновых димеров. Такие мутации называются мишенными мутациями (от слова «мишень») Циклобутановые пиримидиновые димеры вызывают как мишенные мутации замены оснований, так и мишенные мутации сдвига рамки.
Иногда точечные мутации образуются на, так называемых, неповрежденных участках ДНК, часто в небольшой окрестности от фотодимеров. Такие мутации называются немишенными мутациями замены оснований или немишенными мутациями сдвига рамки.
Точечные мутации образуются не всегда сразу же после воздействия мутагена. Иногда они появляются после десятков циклов репликаций. Это явление носит название задерживающихся мутаций. При нестабильности генома, главной причине образования злокачественных опухолей, резко возрастает количество немишенных и задерживающихся мутаций.
Возможны четыре генетических последствия точковых мутаций: 1) сохранение смысла кодона из-за вырожденности генетического кода (синонимическая замена нуклеотида), 2) изменение смысла кодона, приводящее к замене аминокислоты в соответствующем месте полипептидной цепи (миссенс-мутация), 3) образование бессмысленного кодона с преждевременной терминацией (нонсенс-мутация). В генетическом коде имеются три бессмысленных кодона: амбер — UAG, охр — UAA и опал — UGA (в соответствии с этим получают название и мутации, приводящие к образованию бессмысленных триплетов — например амбер-мутация), 4) обратная замена (стоп-кодона на смысловой кодон).
По влиянию на экспрессию генов мутации разделяют на две категории: мутации типа замен пар оснований и типа сдвига рамки считывания (frameshift). Последние представляют собой делеции или вставки нуклеотидов, число которых не кратно трём, что связано с триплетностью генетического кода.
Первичную мутацию иногда называют прямой мутацией, а мутацию, восстанавливающую исходную структуру гена, — обратной мутацией, или реверсией. Возврат к исходному фенотипу у мутантного организма вследствие восстановления функции мутантного гена нередко происходит не за счет истинной реверсии, а вследствие мутации в другой части того же самого гена или даже другого неаллельного гена. В этом случае возвратную мутацию называют супрессорной. Генетические механизмы, благодаря которым происходит супрессия мутантного фенотипа, весьма разнообразны.
Почковые мутации (спорты) — стойкие соматические мутации происходящие в клетках точек роста растений. Приводят к клоновой изменчивости. При вегетативном размножении сохраняются. Многие сорта культурных растений являются почковыми мутациями.
Мутации, которые ухудшают деятельность клетки в многоклеточном организме, часто приводят к уничтожению клетки (в частности, к программируемой смерти клетки, — апоптозу). Если внутри- и внеклеточные защитные механизмы не распознали мутацию и клетка прошла деление, то мутантный ген передастся всем потомкам клетки и, чаще всего, приводит к тому, что все эти клетки начинают функционировать иначе.
Мутация в соматической клетке сложного многоклеточного организма может привести к злокачественным или доброкачественным новообразованиям, мутация в половой клетке — к изменению свойств всего организма-потомка.
В стабильных (неизменных или слабо изменяющихся) условиях существования большинство особей имеют близкий к оптимальному генотип, а мутации вызывают нарушение функций организма, снижают его приспособленность и могут привести к смерти особи. Однако в очень редких случаях мутация может привести к появлению у организма новых полезных признаков, и тогда последствия мутации оказываются положительными; в этом случае они являются средством адаптации организма к окружающей среде и, соответственно, называются адаптационными.
Делеции и инсерции: виды, последствия
Разделы генетики:
Популярные разделы сайта:
Делеции нуклеотидов. Инсерции нуклеотидов. Мутации сдвига рамки считывания. Кроссинговер. Неравный кроссинговер.
Если однонуклеотидные замены, делеции или инсерции нуклеотидов происходят в промоторной области гена, то такие мутации способны нарушать взаимодействие РНК-полимеразы и других белков, участвующих в инициации транскрипции, что приведет к уменьшению или даже прекращению синтеза мРНК на матрице ДНК.
Рис. 4.1. Механизм возникновения дупликации или делеции гена РМР22. а — нормальное спаривание гомологичных участков хромосомы 17р, в которых расположен ген РМР22. По краям участка расположены гомологичные повторы длиной около 30 тыс. п.н.; б — негомологичное спаривание участков хромосомы 17р за счет гомологичных повторов и неравный кроссинго-вер в спаренных гомологичных участках; в — в результате неравного крос-синговера происходят удвоение гена РМР22 в одном из гомологов и его де-леция во втором гомологе (на рис. 4.1 делеция не показана).
Следующий класс молекулярных мутаций — это делеции (утраты) или инсерции (вставки) нуклеотидов. В том случае, когда делетируется или вставляется тройка нуклеотидов, то если этот триплет является кодирующим, в составе полипептида либо исчезает определенная аминокислота, либо появляется новая аминокислота. Однако, если в результате делеции или инсерции вставляется или удаляется число нуклеотидов, не кратное трем, то меняется или утрачивается смысл для всех остальных, следующих за вставкой или делецией кодонов молекулы мРНК. Такие мутации называются мутациями сдвига рамки считывания. Нередко они приводят к образованию стоп-кодона в следующей за инсерцией или делецией последовательности нуклеотидов мРНК.
На схеме показано, что мутация сдвига рамки считывания возникла в результате инсерции пары оснований. Это привело к изменению кодонов после инсерции и аминокислотной последовательности полипептидной цепи.
Одним из механизмов возникновения мутаций является неравный кроссинговере. По-видимому, именно таким образом возникает, например, большая часть делеций/дупликаций в области локализации гена РМР22 на хромосоме, кодирующего периферический белок миелина 22. Участок хромосомы 17, в котором расположен ген РМР22 протяженностью примерно в 1,5 млн п.н., фланкируется двумя высокогомологичными повторами, каждый длиной около 30 тыс. п.н.
P.S. Кроссинговером называется обмен генетическим материалом между гомологичными хромосомами в мейозе I.
Инсерции. Что такое инсерция? Инверсии. Что такое инверсия?
Когда сегмент одной хромосомы переносится и вставляется в другую хромосому, такую перестройку называют инсерцией.
Для того чтобы произошла инсерция, необходимо не менее 3 разрывов хромосом. Поскольку в случае возникновения инсерции не теряется и не добавляется новый генетический материал, такую перестройку считают сбалансированной. Однако у носителей такой инсерции 50 % гамет окажутся несбалансированными, поскольку они будут нести хромосому либо с делецией, либо с инсерцией.
Вследствие этого будут образовываться зиготы с частичной моносомией или частичной трисомией.
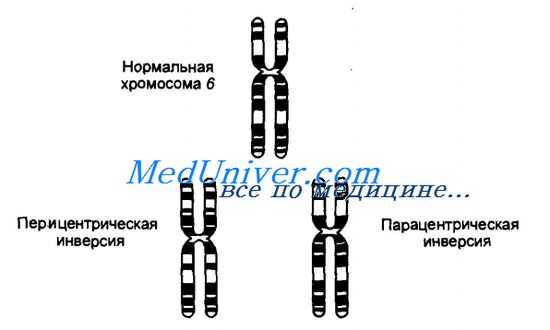
Перицентрическая и парацентрическая инверсии в хромосоме 6.
Инверсии. Что такое инверсия?
Инверсией называют хромосомную мутацию, когда после двух разрывов в одной хромосоме сегмент хромосомы, расположенный между разрывами, поворачивается на 180° и занимает инвертированное положение. Если в инвертированный сегмент попадает центромера, то такую инверсию называют перицентрическои, а если инверсия сегмента хромосомы происходит в пределах одного плеча — парацентрической.
При инверсии не происходит потери генетического материала, кроме тех случаев, когда разрыв хромосомы может затронуть функционально важный ген. Поэтому носители обоих типов инверсий не имеют, как правило, каких-либо патологических симптомов. Более того, некоторые инверсии, например перицентрическая инверсия в хромосоме 9, встречаются как нормальный признак с достаточно высокой частотой в некоторых этнических группах. Как и при других сбалансированных перестройках, инверсии в мейозе могут приводить к образованию несбалансированных гамет.
Это происходит тогда, когда в пределах инверсии возникает хиазма и осуществляется кроссинговер. В случае перицентрической инверсии это приводит к образованию двух комплементарных несбалансированных хромосом.
Одна из них будет иметь дупликацию дистального неинвертированного сегмента и делецию противоположного конца хромосомы, вторая — делецию дистального неинвертированного сегмента и дупликацию противоположного конца хромосомы. Кроссинговер в инвертированном сегменте при парацентрической инверсии, как видно из рисунка, приведет к образованию либо ацентрического фрагмента хромосомы, либо дицентрика.
Механизм образования рекомбинантных несбалансированных хромосом в случае перицентрической (I) и парацентрической (II) инверсии, когда кроссинговер происходит в инверсионной петле
Все 4 типа несбалансированных гамет в случае их участия в оплодотворении дадут нежизнеспособные зиготы, которые элиминируются на ранних стадиях развития. Вероятно, однако, что кроссинговер внутри инверсий может происходить крайне редко, так как конъюгация гомологичных хромосом при наличии в одной из них инверсии затруднена.
У экспериментальных животных инверсии используют как раз для запирания кроссинговера.
Хромосомные нарушения
Данная брошюра содержит информацию о том, что такое хромосомные нарушения, как они могут наследоваться, и какие проблемы могут быть с ними связаны. Данная брошюра не может заменить Ваше общение с врачом, однако она может помочь Вам при обсуждении интересующих Вас вопросов.
Для того, чтобы лучше понять, что представляют собой хромосомные нарушения, вначале будет полезно узнать, что такое гены и хромосомы.
Что такое гены и хромосомы?
Наше тело состоит из миллионов клеток. Большинство клеток содержат полный набор генов. У человека тысячи генов. Гены можно сравнить с инструкциями, которые используются для контроля роста и согласованной работы всего организма. Гены отвечают за множество признаков нашего организма, например, за цвет глаз, группу крови или рост.
Гены расположены на нитевидных структурах, называемых хромосомами. В норме в большинстве клеток организма содержится по 46 хромосом. Хромосомы передаются нам от родителей — 23 от мамы, и 23 от папы, поэтому мы часто похожи на своих родителей. Таким образом, у нас два набора по 23 хромосомы, или 23 пары хромосом. Так как на хромосомах расположены гены, мы наследуем по две копии каждого гена, по одной копии от каждого из родителей. Хромосомы (следовательно, и гены) состоят из химического соединения, называемого ДНК.
Рисунок 1: Гены, хромосомы и ДНК
Хромосомы (см. Рисунок 2), пронумерованные от 1 до 22, одинаковые у мужчин и у женщин. Такие хромосомы называют аутосомами. Хромосомы 23-й пары различны у женщин и мужчин, и их называют половыми хромосомами. Есть 2 варианта половых хромосом: Х-хромосома и Y-хромосома. В норме у женщин присутствуют две Х-хромосомы (ХХ), одна из них передается от матери, другая — от отца. В норме у мужчин есть одна X-хромосома и одна Y-хромосома (XY), при этом Х-хромосома передается от матери, а Y-хромосома — от отца. Так, на Рисунке 2 изображены хромосомы мужчины, так как последняя, 23-я, пара представлена сочетанием XY.
Рисунок 2: 23 пары хромосом, распределенные по размеру; хромосома под номером 1 — самая большая. Две последние хромосомы — половые.
Хромосомные изменения
Правильный хромосомный набор является очень важным для нормального развития человека. Это связано с тем, что гены, которые дают «инструкции к действиям» клеткам нашего организма, находятся на хромосомах. Любое изменение количества, размера или структуры наших хромосом может означать изменение количества или последовательности генетической информации. Такие изменения могут привести к трудностям в обучении, задержке развития и другим проблемам здоровья ребенка.
Хромосомные изменения могут быть унаследованы от родителей. Чаще всего хромосомные изменения возникают на этапе формирования яйцеклетки или сперматозоида, или при оплодотворении (вновь возникшие мутации, или мутации de novo). Эти изменения невозможно контролировать.
Существует два основных типа хромосомных изменений. Изменение числа хромосом. При таком изменении существует увеличение или уменьшение числа копий какой-либо хромосомы. Изменение структуры хромосом. При таком изменении материал какой-либо хромосомы поврежден, или изменена последовательность генов. Возможно появление дополнительного или утрата части исходного хромосомного материала.
В данной брошюре мы рассмотрим хромосомные делеции, дупликации, инсерции, инверсии и кольцевые хромосомы. Если Вас интересует информация о хромосомных транслокациях, пожалуйста, обратитесь к брошюре «Хромосомные транслокации».
Изменение числа хромосом.
В норме в каждой клетке человека содержится 46 хромосом. Однако, иногда ребенок рождается либо с большим, либо с меньшим числом хромосом. В таком случае возникает, соответственно, либо избыточное, либо недостаточное число генов, необходимых для регуляции роста и развития организма.
Один из наиболее распространенных примеров генетического заболевания, вызванного избыточным числом хромосом, является синдром Дауна. В клетках людей с этим заболеванием находится 47 хромосом вместо обычных 46-ти, так как присутствует три копии 21-ой хромосомы вместо двух. Другими примерами заболеваний, вызванных избыточным числом хромосом являются синдромы Эдвардса и Патау.
Рисунок 3: Хромосомы девочки (последняя пара хромосом ХХ) с синдромом Дауна. Видны три копии 21-ой хромосомы вместо двух.
Изменение структуры хромосом.
Изменения в структуре хромосом происходят, когда материал определенной хромосомы поврежден, или изменена последовательность генов. К структурным изменениям также относятся избыток или утрата части хромосомного материала. Это может происходить несколькими путями, описанными ниже.
Изменения структуры хромосом могут быть очень небольшими, и специалистам в лабораториях бывает сложно их выявить. Однако даже если структурное изменение найдено, часто бывает сложно предсказать влияние этого изменения на здоровье конкретного ребенка. Это может разочаровать родителей, которые хотят получить исчерпывающую информацию о будущем своего ребенка.
Транслокации
Если Вы хотите больше узнать о транслокациях, пожалуйста, обратитесь к брошюре «Хромосомные транслокации».
Делеции
Термин «хромосомная делеция» означает, что часть хромосомы утрачена или укорочена. Делеция может случиться в любой хромосоме и на протяжении любой части хромосомы. Делеция может быть любого размера. Если утраченный при делеции материал (гены) содержал важную информацию для организма, то у ребенка могут возникать трудности в обучении, задержка развития и другие проблемы со здоровьем. Тяжесть этих проявлений зависит от размеров утраченной части и локализации внутри хромосомы. Примером такого заболевания является синдром Жубер.
Дупликации
Термин «хромосомная дупликация» означает, что часть хромосомы удвоена, и из-за этого возникает избыток генетической информации. Этот избыточный материал хромосомы означает, что организм получает слишком большое число «инструкций», и это может привести к трудностям в обучении, задержке развития и другим проблемам здоровья ребенка. Примером заболевания, вызванного дупликацией части хромосомного материала является моторно-сенсорная нейропатия типа IA.
Инсерции
Хромосомная инсерция (вставка) означает, что часть материала хромосомы оказалась «не на своем месте» на этой же или на другой хромосоме. Если общее количество хромосомного материала не изменилось, то такой человек, как правило, здоров. Однако если такое перемещение приводит к изменению количества хромосомного материала, то у человека могут возникать трудности в обучении, задержка развития и другие проблемы здоровья ребенка.
Кольцевые хромосомы
Термин «кольцевая хромосома» означает, что концы хромосомы соединились, и хромосома приобрела форму кольца ( внорме хромосомы человека имеют линейную структуру). Обычно это происходит, когда оба конца одной и той же хромосомы укорочены. Оставшиеся концы хромосомы становятся «липкими» и соединяются, формируя «кольцо». Последствия формирования кольцевых хромосом для организма зависят от размера делеций на концах хромосомы.
Инверсии
Хромосомная инверсия означает такое изменение хромосомы, при котором часть хромосомы развернута, и гены в этом участке расположены в обратном порядке. В большинстве случаев носитель инверсии здоров.
Если у родителя обнаружена необычная хромосомная перестройка, как это может отразиться на ребенке?
Возможны несколько исходов каждой беременности:
- Ребенок может получить совершенно нормальный набор хромосом.
- Ребенок может унаследовать такую же хромосомную перестройку, которая есть у родителя.
- У ребенка могут быть трудности в обучении, задержка развития или другие проблемы со здоровьем.
- Возможно самопроизвольное прерывание беременности.
Таким образом, у носителя хромосомной перестройки могут рождаться здоровые дети, и во многих случаях происходит именно так. Так как каждая перестройка уникальна, Вашу конкретную ситуацию следует обсудить с врачом-генетиком. Часто бывает, что ребенок рождается с хромосомной перестройкой, несмотря на то, что хромосомный набор родителей нормальный. Такие перестройки называют вновь возникшими, или возникшими “de novo” (от латинского слова). В этих случаях риск повторного рождения ребенка с хромосомной перестройкой у этих же родителей очень мал.
Диагностика хромосомных перестроек
Возможно проведение генетического анализа для выявления носительства хромосомной перестройки. Для анлиза берется образец крови, и клетки крови исследуют в специализированной лаборатории для выявления хромосомных перестроек. Такой анализ называется кариотипированием. Также возможно проведение теста во время беременности для оценки хромосом плода. Такой анализ называется пренатальной диагностикой, и этот вопрос следует обсудить с врачом-генетиком. Более подробная информация на эту тему представлена в брошюрах «Биопсия ворсин хориона» и «Амниоцентез».
Как это касается других членов семьи
Если у одного из членов семьи обнаружена хромосомная перестройка, возможно, Вы захотите обсудить этот вопрос с другими членами семьи. Это даст возможность другим родственникам, при желании, пройти обследование (анализ хромосом в клетках крови) для определения носительства хромосомной перестройки. Это может быть особенно важно для родственников, уже имеющих детей или планирующих беременность. Если они не являются носителями хромосомной перестройки, они не могут передать ее своим детям. Если же они являются носителями, то им может быть предложено пройти обследование во время беременности для анализа хромосом плода.
Некоторым людям сложно обсуждать проблемы, связанные с хромосомной перестройкой, с членами семьи. Они могут бояться причинить беспокойство членам семьи. В некоторых семьях люди из-за этого испытывают сложности в общении и теряют взаимопонимание с родственниками. Врачи-генетики, как правило, имеют большой опыт в решении подобных семейных ситуаций и могут помочь Вам в обсуждении проблемы с другими членами семьи.
Внутрихромосомные изменения и их последствия для организма. Дефишенси, делеции, дупликации, инверсии, инсерции, транспозиции. Эффект положения гена
Внутрихромосомные изменения разделяются на три группы: 1) нехватки, 2) дупликации и 3) инверсии. Нехватка выражается в утрате хромосомой какого-нибудь ее участка, несущего определенную наследственную информацию. Дупликация представляет собой прямо противоположный процесс, заключающийся в том, что одновременно с потерей участка одной хромосомой у другой, гомологичной хромосомы может появиться новый участок, идентичный уже имеющемуся. В результате происходит удвоение участка. При инверсии участок хромосомы меняет свою ориентацию. Предполагается, что инверсия наступает после двух разрывов одной хромосомы, когда внутренний участок хромосомы разворачивается на 180° и разрывы воссоединяются.
Межхромосомные перестройки протекают по типу , транслокации.
При транслокации участки двух хромосом обмениваются местами. Такой обмен может произойти в результате перекреста двух гомологичных или негомологичных хромосом, при котором возникают разрывы, после чего разорванные концы хромосом соединяются по-новому.
Выявление различных типов хромосомных изменений проливает свет на причины возникновения гомологичных и аналогичных рядов наследственной изменчивости. Закон гомологичных рядов был открыт Н. И. Вавиловым на основе изучения фенотипов. В настоящее время становится очевидным, что одним из основных механизмов, обусловливающих формирование гомологичных рядов мутаций у близких видов, является сходство в процессах хромосомных перестроек.
Экспериментальное изучение причин мутационного процесса показывает его зависимость как от влияния нарушений в метаболизме, так и от прямого воздействия факторов внешней среды. Впервые возможность изменения наследственности внешними факторами была выявлена в 1925 г., когда Г. А. Надсон и Г. С. Филиппов показали влияние лучей радия на наследственную изменчивость у грибов. В 1927 г. Г. Меллер на дрозофиле установил, что облучение увеличивает частоту возникновения мутаций по сравнению с частотой спонтанных мутаций, т. е. наблюдаемых в естественных условиях.
В опытах было показано, что влияние ионизирующего излучения на мутационный процесс не сводится только к хромосомным мутациям. Облучение, глубоко затрагивая обмен веществ, ведет к химическому изменению молекул ДНК. Сущность этого процесса выяснилась тогда, когда впервые были обнаружены химические вещества, обладающие мутагенными свойствами.
Среди химических мутагенов имеются как неорганические (азотистая кислота, хлористый алюминий, перекись водорода), так и органические вещества. Из последних особый интерес представляют аналоги азотистых оснований, так как проведенные с ними опыты показали один из возможных путей мутационного изменения молекулы ДНК. Само название «аналоги» показывает, что они имеют общие черты строения с нормальными основаниями ДНК, что видно, например, из сравнения структурных формул тимина (Т) и его аналога — бромурацила (БУ): Тимин 5-бромурацил
Подобные аналоги обычно отсутствуют в организмах, поэтому их называют антиметаболитами. При введении их в клетку аналоги оснований во время синтеза молекул ДНК становятся на место соответствующих нормальных оснований: так, бром-урацил (БУ), будучи введен в клетку бактерии (Salmonella), может занять место тимина (Т). Возникает ненормальная пара оснований (БУ-А вместо Т-А). Само включение БУ в цепь еще не представляет собой мутации, так как ген, включивший БУ, не может производить копии, содержащие это необычное основание, если оно больше не поступает в клетку из среды. При репликации БУ обычно присоединяет аденин (А), и тогда при второй репликации восстанавливается исходная структура (Т-А). Однако в некоторых случаях при второй репликации против БУ встает другое основание — гуанин (Г); тогда в третьей репликации против гуанина встанет его нормальный партнер- цитозин (Ц). Произойдет типичная генная мутация: в молекуле ДНК исходная пара оснований (Т-А) в данном локусе будет заменена новой (Ц-Г). Описанный процесс можно представить следующей схемой:
Схема показывает, что в результате «ошибки репликации» изменяется структура одного звена в гене, а это, как мы знаем, приводит к изменению кода, регулирующего синтез определенного белка.
Такого рода «ошибки репликации» учащаются при воздействии внешних факторов, например при повышении температуры; .оп^тиг. итп трп.ппяпй шок вызывает мутации. Увеличение числа мутаций вследствие повышения температуры происходит не только в экспериментах, но и в природе. Было показано, что у некоторых видов Crepis, растущих в диком состоянии в Швейцарии, семена растений из более высоко расположенных мест дают большую частоту мутаций (в структуре побегов), чем семена растений из более низких мест. На высоко расположенных участках поверхность почвы часто очень сильно прогревается солнцем (до 50°), и это усиливает мутационный процесс в семенах, которые долго лежат в почве, прежде чем начнут прорастать.
Стимулирующее влияние температурного фактора на мутационный процесс объясняется тем, что при повышении температуры в организме ускоряется течение всех химических процессов; ускоряются и химические реакции в хромосомах. Высокая температура может явиться причиной как хромосомных перестроек, так и внутримолекулярных изменений.
Многочисленные исследования последних лет убеждают, что любые условия, выводящие организм из оптимального состояния, могут быть в той или иной степени мутагенными.
Хромосомные мутации (перестройки, или аберрации) — это изменения в структуре хромосом, которые можно выявить и изучить под световым микроскопом.
Известны перестройки разных типов (рис. 3.13):
1. нехватка, или дефишенси, — потеря концевых участков хромосомы;
2. делеция — выпадение участка хромосомы в средней ее части;
3. дупликация — двух- или многократное повторение генов, локализованных в определенном участке хромосомы;
4. инверсия — поворот участка хромосомы на 180°, в результате чего в этом участке гены расположены в последовательности, обратной по сравнению с обычной;
5. Инсерция — тип хромосомной перестройки, заключающийся в появлении вставки в каком-либо участке нуклеотидной последовательности.
6. транслокация — изменение положения какого-либо участка хромосомы в хромосомном наборе. К наиболее распространенному типу транслокаций относятся реципрокные, при которых происходит обмен участками между двумя негомологичными хромосомами. Участок хромосомы может изменить свое положение и без реципрокного обмена, оставаясь в той же хромосоме или включаясь в какую-то другую.
При дефишенси, делециях и дупликациях изменяется количество генетического материала. Степень фенотипического изменения зависит от того, насколько велики соответствующие участки хромосом и содержат ли они важные гены. Примеры дефишенси известны у многих организмов, включая человека. Тяжелое наследственное заболевание —синдром «кошачьего крика» (назван так по характеру звуков, издаваемых больными младенцами), обусловлен гетерозиготностью по дефишенси в 5-й хромосоме. Этот синдром сопровождается сильным нарушением роста и умственной отсталостью. Обычно дети с таким синдромом рано умирают, но некоторые доживают до зрелого возраста.
Проявление активности гена может зависеть от его локализации в хромосоме. Так, изменение доминантности гена может произойти вследствие изменения расположения соседних генов. Рассмотрим пример. У дрозофилы в IV-хромосоме имеется рецессивный ген, влияющий на жилкование крыльев. У гомозиготы одна из жилок крыла прерывается по данному гену. В результате перекреста хромосом в IV-хромосому можно внедрить небольшой участок хромосомы (опыт Н. П. Дубинина) таким образом, что он окажется расположенным по соседству с этим рецессивным геном. Дрозофила, взятая для эксперимента, несла нормальный доминантный ген и должна была иметь нормальные, со всеми жилками крылья. Однако как только произошел подобный обмен участками хромосом, начал проявляться рецессивный ген и одна из жилок оказалась прерванной. Генетический анализ показал, что никакого изменения в самом гене не произошло. Наблюдаемое нарушение крыла было вызвано только изменением в окружении гена. Это явление и было названо эффектом положения гена. Другим характерным примером является наличие в хромосоме дрозофилы гена Хэйри. Он рецессивен и в гомозиготном состоянии вызывает появление дополнительных щетинок. Гетерозиготы по этому гену дополнительных щетинок не имеют. Если к хромосоме присоединяется фрагмент IV-хромосомы, ген Хэйри начинает активно образовывать щетинки, несмотря на свою рецессивность. Если с помощью кроссинговераперенести рецессивный ген Хэйри из полученной гибридной хромосомы в нормальную, он снова становится рецессивным. Классическим примером эффекта положения гена служит анализ наследования доминантного гена Ваг. Этот ген, расположенный в Х-хромосоме, вызывает образование полосковидных глаз вместо круглых. Гомозиготная самка Ваг с двумя генами Ваг имеет более узкие глаза, чем самец, единственная Х-хромосома которого имеет один ген Ваг. Изучение хромосом слюнных желез дрозофилы показало, что ген Ваг возникает в результате удвоения небольшого участка хромосомы, содержащего четыре диска. В хромосомах, несущих ген Ваг, этот участок представлен дважды. В потомстве таких гомозиготных самок могут возникать хромосомы, содержащие три гена Ваг. Такие хромосомы обеспечивают появление признака ультра-Ваг, и у дрозофилы глаза становятся гораздо уже, чем глаза у гомозиготных самок. Гетерозиготная самка ультра-Ваг с одной нормальной хромосомой и одной хромосомой ультра-Ваг имеет столько же участков Ваг, сколько гомозиготная самка с полосковидными глазами. Однако у гетерозиготы глаза значительно меньше, чем у гомозиготы. Таким образом, данный пример хорошо иллюстрирует зависимость активности гена от его положения. Эффект положения может быть следствием структурных перестроек хромосом. По характеру проявления он бывает доминантным, рецессивным, летальным, в некоторых случаях может изменять проявление количественных признаков или действовать как модификатор доминантности и пенетрантности других генов. Для объяснения эффекта положения выдвинуты две гипотезы: 1) кинетическая, объясняющая данное явление нарушением локального взаимодействия между генами и генными продуктами. 2) структурная, рассматривающая эффект положения как результат физического изменения локуса, которое приводит к изменению структуры нуклеопротеида.
Изменчивость за счет вариаций в числе хромосом и их последствия для организмов. Гаплоиды и полиплоиды, сбалансированные и несбалансированные полиплоиды. Практическое использование этого явления.
Геномныемутации затрагивают геном клетки и вызывают изменение числа хромосом в геноме. Это может происходить за счет увеличения или уменьшения числа гаплоидных наборов или отдельных хромосом. К геномным мутациям относят полиплоидию и анеуплоидию.
Полиплоидия —геномная мутация, состоящая в увеличении числа хромосом, кратному гаплоидному. Клетки с разным числом гаплоидных наборов хромосом называются: 3n — триплоидами, 4n тетраплоидами и т.д. Полиплоидия приводит к изменению признаков организма: увеличению плодовитости размеров клеток, биомассы. Используется в селекции растений. Полиплоидия известна и у животных, например, у инфузорий, тутового шелкопряда, земноводных.
Анеуплоидия — изменение числа хромосом, некратное гаплоидному набору: 2n + 1; 2n — 1; 2n — 2; 2n +2. У человека такие мутации вызывают патологии: синдром трисомии по Х-хромосоме, трисомия по 21-й хромосоме (болезнь Дауна), моносомия по Х-хромосоме и т.д. Явление анеуплоидии показывает, что нарушение числа хромосом приводит к изменению в строении и снижению жизнеспособности организма.
Гаплоидные клетки — живые клетки, в отличие от диплоидных клеток содержащие одинарный набор хромосом. Каждая хромосома представлена в таких клетках единственной копией, а каждый ген — одним аллелем. Поэтому у гаплоидных организмов проявляются все вновь возникшие мутации (нет явления доминантности и рецессивности). Частным случаем гаплоидных клеток являются гаметы.
Пло́идность — число одинаковых наборов хромосом, находящихся в ядре клетки или в ядрах клеток многоклеточного организма.
Чрезвычайно велико значение П. в становлении новых видов растений. Близкородственные виды растений одного рода часто укладываются в так называемые полиплоидные ряды (пшеницы с 14 или 28, или 42 хромосомами и др.). Морфологические и физиологические преимущества полиплоидных видов позволяют им иногда заселять новые ареалы, недоступные из-за суровых условий для других видов. Установлено, что и в селекции сельскохозяйственных растений человек, не подозревая того, веками вел искусственный отбор полиплоидных форм, от которых ныне получают основную массу пищевых и кормовых белков, жиров и углеводов. Освоение метода экспериментального создания полиплоидов уже привело к внедрению некоторых из них в сельскохозяйственную практику (триплоидные сахарная свекла, перечная мята и др.).
Перспективный метод получения полиплоидных форм часто сочетают с искусственной гибридизацией. Полиплоидия — единственный метод преодоления бесплодия гибридов, полученных в результате скрещивания отдаленных видов.
В эволюции животных полиплоидия не получила такого значения, как у растений. Этому, по-видимому, препятствовал сложный механизм определения пола (см.) у животных. Однако там, где этот барьер снят, где имеет место партеногенетическое размножение, возникли полиплоидные виды, завоевавшие более или менее обширные ареалы.
Случаи возникновения спонтанной полиплоидии у животных наблюдаются так же, как и у растений; освоено и их получение в эксперименте. Это ставит вопрос и об их практическом использовании. Первые шаги уже сделаны в нашей стране В. Л. Астауровым, получившим размножающиеся полиплоиды шелкопряда. Отдельные случаи П. обнаружены и у человека.
Понятие о спонтанном и индуцированном мутагенезе. Сходство и различия. Частота появления спонтанных и индуцированных мутаций. Гомологические ряды наследственности. Важность для научного познания наследственности и изменчивости.
Спонтанный мутагенез, т.е. процесс возникновения мутаций в организме в отсутствие намеренного воздействия мутагенами, представляет собой конечный результат суммарного воздействия различных факторов, приводящих к повреждениям генетических структур в процессе жизнедеятельности организма.
Причины возникновения спонтанных мутаций можно разделить на:
• экзогенные (естественная радиация, экстремальные температуры и др.);
• эндогенные (спонтанно возникающие в организме химические соединения-метаболиты, вызывающие мутагенный эффект; ошибки репликации, репарации, рекомбинации; действие генов-мутаторов и антимутаторои; транспозиция мобильных генетических элементов и др.).
Основным источником спонтанных мутаций служат эндогенные факторы, приводящие к повреждению генов и хромосом в процессе нормального клеточного метаболизма. Результат их действия — ошибки генетических процессов репликации, репарации и рекомбинации.
Читайте также:
- Операция Бокштейн на ухе. Техника операции Бокштейн
- Рейки
- Женственность и желанная женщина. Секреты настоящей женственности
- Рак толстой кишки: симптомы на ранних стадиях опухоли кишки
- Гомеостаз жидкостей организма. Оценка трофологического статуса
К чему может привести ошибка в последовательности нуклеотидов?
Сроооочно помогитее!
Вы открыли страницу вопроса К чему может привести ошибка в последовательности нуклеотидов?. Он относится к категории
Химия. Уровень сложности вопроса – для учащихся 5 — 9 классов.
Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие
ответы по интересующей теме. Чтобы получить наиболее развернутый ответ,
можно просмотреть другие, похожие вопросы в категории Химия,
воспользовавшись поисковой системой, или ознакомиться с ответами других
пользователей. Для расширения границ поиска создайте новый вопрос, используя
ключевые слова. Введите его в строку, нажав кнопку вверху.
Что такое онкоген? Как возникают мутации в ДНК? Какие мутации провоцируют рак? Кому и чем могут помочь молекулярно-генетические исследования?
На эти и другие вопросы во Всемирный день ДНК отвечает Александр Олегович Иванцов – доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Александр Олегович Иванцов, доктор медицинских наук
— Александр Олегович, что такое мутация? Как возникают «поломки» в молекулах ДНК?
— Организм человека состоит из большого числа специализированных клеток, ядра которых содержат нуклеиновые кислоты: ДНК и РНК. Совокупность этих молекул содержит биологическую информацию, необходимую для построения и поддержания клеток, органов и систем органов в целом. Весь наследственный материал, заключённый в клетке, получил название – геном. У человека он представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре. ДНК является длинной полимерной молекулой, она хранит биологическую информацию в виде генетического кода, состоящего из последовательности повторяющихся блоков — нуклеотидов. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, которые необходимы для последующего биосинтеза важнейших белков. Открытие структуры ДНК в 1953 году стало поворотным моментом в развитии биологии, а исследователям Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия в 1962 году. Стойкое изменение генома получило название – мутация. Эти изменения могут касаться структуры отдельных генов, хромосом и генома в целом. То есть изменение последовательности нуклеотидов приводит к нарушениям в кодировании информации – в итоге к аномалиям на уровне качества или количества соответствующих белков.
— Почему некоторые мутации приводят к развитию рака? Как устроен этот механизм? Как ученые определяют, какие именно «поломки» в ДНК приводят к развитию злокачественных опухолей?
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?
— Да, конечно, можно. Спектр генетических повреждений в опухолях характеризуется удивительным многообразием. Например: амплификации (увеличение копийности генов), делеции, инсерции, транслокации, микромутации (точковые замены, микроделеции, микроинсерции) и так далее. Кроме того, в опухоли изменяются уровни экспрессии генов в результате аномального метилирования их промоторов.
Существует много методов, используемых для выявления мутаций в опухолевой ткани, и достаточно много ситуаций, когда это требуется. Выявление определённых мутаций иногда помогает поставить диагноз, определить лечебную тактику, прогноз и так далее. Наиболее часто для молекулярного тестирования используются технологии полимеразной цепной реакции (ПЦР) и секвенирования нового поколения (NGS, next generation sequencing). Обе технологии универсальны и используются для анализа любой генетической последовательности, а также многократно превосходят все другие технологии по своей чувствительности, специфичности и не сопряжены с риском получения «промежуточных», неинтерпретируемых результатов. Секвенирование экзома позволяет выявить все мутации в кодирующих последовательностях генома в каждой конкретной опухоли. Именно полногеномное секвенирование значительно расширяет возможности персонализированного подбора препаратов, предназначенных для специфического поражения мутированных онкобелков.

— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
— Вообще, бывают наследственные и ненаследственные опухоли. Наследственные опухолевые синдромы составляют незначительную долю от общего числа новообразований (около 1%), хотя для определённых локализаций (молочная железа, яичник, толстая кишка) их удельный вклад достигает более высоких показателей (5-20 %). Носительство наследуемой «раковой» мутации является причиной подобного заболевания. В этих случаях, в каждой клетке организма человека есть повреждение, которое передалось ему по наследству. Лица, имеющие такой генетический дефект, остаются практически здоровыми до определенного момента. В то же время они обладают фатально высоким риском возникновения опухолей (85-100%).
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— Какие исследования, связанные с мутациями ДНК, сейчас проводятся в научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»?
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.