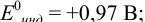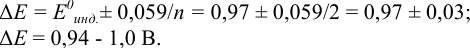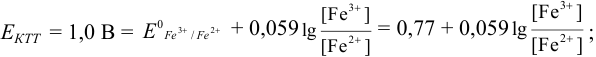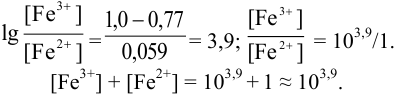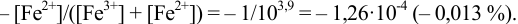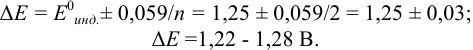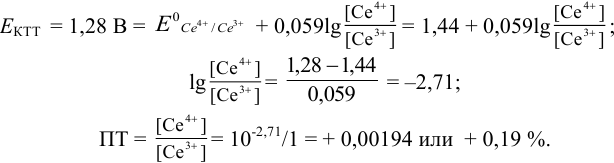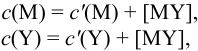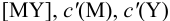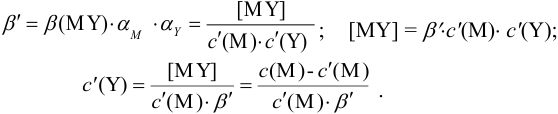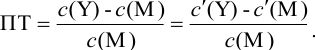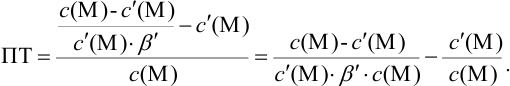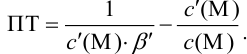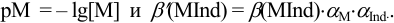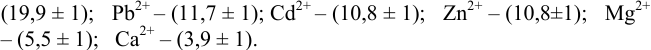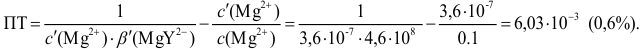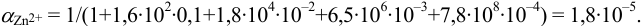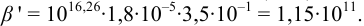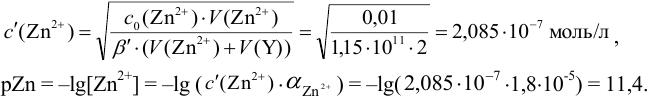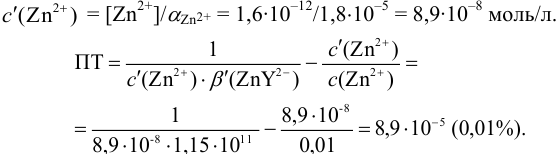Индикаторные
погрешности – систематические
погрешности, связанные с используемыми
индикаторами. Эта погрешность связана
с тем, что рТ применяемого индикатора
не совпадает со значением рН в ТЭ.
Индикаторная
погрешность-это систематическая
погрешность.
%
или
%
Можно
выразить ПТ через f:
или
При
титровании HCl
с NаOH
возникает водородная погрешность. Она
возникает, если рТ<7, т.е при титровании
сильной кислоты сильным основанием,
после окончания титрования остается
избыток неоттитрованной кислоты (рТ<рН)
ПТ%
=
При
перетитровании HCl
(pT>pH):
ПТ%
=
При
титровании 0,5 М HCl
с 0,5 М NаОН
используем фенолфталеин, (рТ=9), значение
рН в ТЭ равно 7
При использовании
фф (рТ=9) погрешность титрования
положительна (раствор перетитрован ):
ПТ%
=
%
При использовании
метилоранжа (рТ=4) погрешность отрицательна
(раствор недотитрован):
ПТ%
=
%
Сравнивая значения
погрешностей можно сделать вывод, что
целесообразней использовать фенолфталеин.
Значительная погрешность возникает
при титровании, если использовать
индикатор с рТ<4
5. Вывод:
-
Был
построен график зависимости рН системы
от степени оттитрованности раствора
в процессе титрования 0,5 М HCl
и 0,5 М NаОН,
называемый кривой титрования. Эта
кривая является монологарифмической,
т.к до ТЭ показатель концентрации
зависит от концентрации другой формы. -
Определен
скачок титрования (рН=2.3-11.7) 8,9 единиц,
который зависит от :
I
Константы диссоциации : чем слабее
кислота, тем выше рН в начале титрования
и в области буферного действия,
следовательно, скачок уменьшается. Если
для кислоты К<5*10,
то скачок отсутствует.
II
Чем меньше концентрация титруемого
вещества и титранта, тем меньше скачок.
II
При повышении температуры (т.к степень
ионизации воды изменяется) скачок
уменьшается и смещается в более кислую
область.
c.
При титровании сильной кислоты сильным
основанием можно использовать
большое количество индикаторов точка
эквивалентности совпадает с точкой
нейтральности.
III Титрование 0,1 м раствора AgNo 0,1 м раствором kCl
1 Осадительное титрование.
Осадительные
методы имеют ограниченное значение.
Лишь очень немногие процессы осаждения
отвечают всем требованиям, предъявляемым
к реакциям в титриметрии. Ограничения
связаны главным образом с неколичественным
и нестехиометрическим протеканием
реакций. Удовлетворительны с этой точки
зрения реакции осаждения галогенидов
и тиоцианата серебра (аргентометрия),
а также ряда соединений ртути (I).
2 Вывод формул pCl на различных этапах титрования.
В
процессе титрования изменяется
концентрация осаждаемого иона – хлорид
иона Cl—,
поэтому кривые титрования целесообразно
строить в координатах pCl
– f
(логарифмические кривые).
1)
До начала титрования ( f=0)
определяется начальной концентрацией
AgNO3,
т.е. pCl
= -Lg
C0[Cl—]
=
=
=
=
=
2)
До первой точки эквивалентности ( 0<f<1),
Cl
осаждается ионами серебра Ag+.
Ag+
+ Cl—
= AgCl
Концентрация
хлорид — ионов определяется количеством
прибавленного титранта и произведением
растворимости образующегося осадка.
[Cl—]
=
+
Так
как KS
= 1,8*10-10,
<<
,
то слагаемым
можно пренебречь.
[Cl—]
=
=
= С0
* (1 —
)
= С0
* (1-f)
pCl
= — LgC0
– Lg(1-f)
3)
В точке эквивалентности ( f=1)
концентрация хлорид — ионов в титруемом
растворе определяется только произведением
растворимости хлорида серебра.
KS
= [Ag+][Cl—]
[Ag+]
= [Cl—]
[Cl—]
=
pCl
=
PKS
4)
После точки эквивалентности ( f>1)
концентрация хлорид – ионов определяется
произведением растворимости KOH,
но уже с учетом избытка титранта.
pCl
= pKS
+ Lg(СT(
f-1))
По
выведенным формулам вычислим значения
pCl
в различные моменты титрования и построим
кривую титрования.
В табл. Д.20 приведены некоторые реакции осадительного 1и комплексометрического титрования, редокс-пары и индикаторные электроды . [c.313]
В каких методах осадительного титрования в качестве индикаторных используются реакции образования а) окрашенных малорастворимых соединений б) окрашенных комплексных соединений в) окрашенных адсорбционных соединений [c.262]
Однако точка максимального наклона кривой потенциометрического титрования достаточно часто не соответствует точке эквивалентности. Это происходит в тех случаях, когда определяемые ионы и ионы титранта имеют различные заряды, т е. стехиометрия реакции отличается от соотношения 1 Г Точка максимального наклона -образной кривой находится с той стороны от точки эквивалентности, где в избытке присутствует ион с меньшим зарядом. Ошибка титрования возрастает при увеличении произведения растворимости осадка в осадительном титровании, при уменьшении силы кислоты или основания в кислотно-основном титровании и при уменьшении прочности комплексов в комплексонометрическом титровании. Несовпадение точки эквивалентности и точки максимального наклона наблюдается также тогда, когда индикаторный электрод обратим лишь к одному из титруемых ионов или крутизна электродных функций к титруемому иону и иону-титранту различна. [c.248]
Изучение скорости диффузионных процессов по средним концентрациям диффундирующих компонентов в волокне, выходящем из осадительной ванны, получило широкое распространение при формовании синтетических волокон [31, 32]. Этот метод дает также удовлетворительные результаты для вискозных волокон, если принять необходимые меры для удаления механически захваченной ванны. Однако наибольшее распространение при изучении диффузионных процессов в технологии вискозных волокон получил индикаторный метод. Первые исследования с применением этого метода были выполнены Каргиным [33]. Дальнейшее развитие он получил в работах других авторов [34— 36]. Недостатком этого [c.180]
Системы электрода. В осадительном титровании в качестве индикаторного электрода часто служит металл, обратимый относительно собственных катионов. Можно использовать мембранные электроды, чувствительные к одному из ионов, участвующих в процессе титрования. [c.454]
Возможность разряда осадков на индикаторном электроде необходимо учитывать при осадительных титрованиях, так как образующиеся осадки могут оказывать весьма существенное влияние на ход кривой титрования. Примером может служить титрование [c.56]
Осадительное и комплексиметрическое титрование. Индикаторные электроды в методах осаждения и комплексообразования являются более или менее избирательными. В этих методах применяются электроды, известные в электрохимии как электроды I, И и П1 родов, а также соответствующие ионоселективные электроды. [c.109]
Индикаторная ошибка титрования вычисляется аналогично ошибке в осадительном титровании. Для атого нужно знать концентрацию взятого для титрования [Ме], [Ме] в точке эквивалентности, которая вычисляется на основании константы устой чивости комплекса с ЭДТА при данном pH и [Ме] в момент, когца инцикатор меняет окраску. Эта величина вычисляется с использованием константы устойчивости комплекса металла с инцикатором. [c.117]
При определении анионов можно также использовать электроды второго и третьего рода. К электродам второго рода от-лоситс , например, описанный выше каломельный электрод. (Как было указано, его можно применять для измерения концентрации ионов С1 в растворе, а следовательно, и в качестве индикаторного в осадительном титровании для реакций, про-текаюших с участием этих ионов. [c.313]
В осадительном и комплексонометрическом потенциометрическом титровании применяются более селективные ицрикаторные электроды. Это объясняется тем, что ионы, входящие в состав осадков или комплексов, имеют разную природу, а индикаторный электрод должен быть обратимым относительно хотя бы одного из них. [c.234]
Сравните причины возникновения индикаторных ошибок титрования в осадительном титровании (прямая тиоциапато-метрия и меркурометрия в присутствии индикатора [Ре(8СН)п] ) и в кислотно-основном титровании (ацидимет-рия и алкалиметрия с метиловым красным и фенолфталеином). [c.58]
Одним из методов обнаружения конечной точки титрования является потенциометрия. В кулонометрической кислотно-основной титриметрии в паре с мембранным стеклянным электродом используют каломельный полуэлемент, в то время как платиновый или золотой индикаторный электрод применяют в редокс определениях. Комплексонометрическое титрование с электрогенерацией этилендиаминтетраацетата-иона (ЭДТА) можно контролировать с помощью ртутного индикаторного электрода, описанного в предыдущей главе, а точку эквивалентности в осадительном титровании обнаруживают, используя серебряный или [c.434]
Осадительное титрование. Если стеклянный мембранный электрод заменить серебряным индикаторным электродом для потенциометрического обнаружения конечной точки титрования, то элемент, изображенный на рис. 12-10, может служить для титрований ионами серебра, генерируемыми на аноде. Отдельные галогенид-ионы могут быть определены с незначительной погрешностью возможно также анализиро- [c.436]
Лабораторные испытания приборов проводились на наиболее распространенных в аналитической практике примерах кислотноосновного, окислительно-восстановительного, комплексономет-рического и осадительного титрования в водной и неводной средах. Для титрования использовались стеклянный, платиновый и серебряный индикаторные электроды в паре с насыщенным каломельным электродом, входящими (кроме серебряного) в комплект к потенциометру Л11-58. [c.133]
В одном из методов, применяюш,ихся в кислотно-основном, осадительном и окислительно-восстановительном титровании, электрод сравнения заменяют компенсационным электродом (рис. П. 17), потенциал которого равен потенциалу индикаторного электрода в данном растворе в конечной точке титрования (этот потенциал определяют заранее). Электроды, обратимые по отношению к одному из ионов, соединяют через гальванометр и определяют конечную точку титрования по изменению полярности электрода. В начале титрования наблюдаются большие отклонения гальванометра, которые постепенно уменьшаются до нуля при приближении к конечной точке титрования и затем увеличиваются в противоположном направлении. Этот очень простой метод определения конечной точки, требуюш.ий лишь чувствительного гальванометра, идеален для рутинной работы. [c.168]
Описан метод амперометрического осадительного титрования ванадия(У) раствором AgNOз [51]. Индикаторный капающий ртутный электрод имел потенциал — 0,3 В (н.к.э.), фоновым электролитом служил раствор нитрата натрия. [c.253]
Мешающее действие ионов натрия, калия, аммония и кальция очень мало при определении эфедрина и метилэфедрина обоими электродами. Кофеин, антипирин, аспирин, аминопирин, витамин С и сульфирин также не влияют на результаты определения. Ионы дифениламина и хлорфениламина в значительной степени мешают определению. Наряду с прямым потенциометрическим определением эфедрина или метилэфедрина ПВХ-мембранные электроды можно применить в качестве индикаторного электрода для осадительного титрования 10 М раствором тетрафенилбората натрия. [c.185]
Для реакций, характеризующихся средними значениями констант диссоциации или произведений растворимости, применение этого метода не позволяет получить правильного результата анализа. Так, на рис. 4.6 представлены графики функции Грана, рассчитанные из результатов титрования хлорида натрия нитратом серебра с сульфид-серебряным индикаторным электродом. Как видно из графика, погрешность анализа при нахождении экстраполяцией отдельных ветвей, линеаризованных кривой титрования, может достигать 25% [67]. При исходной концентрации хлорида М (или более) метод Грана позволяет получить правильный результат анализа, но при уменьшении начальной концентрации хлорида до 10 » М наблюдается значительное отклонение функции Грана от линейности. Авторы [67] предложили модифицированный метод Грана для потенциометрического осадительного титрования, когда индикаторный электрод обратим и к гитруемому иону, и к иону титранта, позволяющий за счет введения в функцию Грана поправочных коэффициентов повысить правильность нахождения эквивалент- [c.92]
Косвенные потенциометрические методы. Чаще всего потенциометрические измерения используют для определения точки эквивалентности в титриметрическом анализе (потенциометрическое титрование). В ациди- или алкалиметрии в качестве индикаторного электрода, как правило, применяют стеклянный электрод, так как его потенциал зависит от pH среды. В оксидиметрическом титровании применяют редокс-элек-трод в осадительном и комплекси-метрическом — ионоселективные электроды. [c.487]
Теоретическое описание различных вариантов титриметриче-ского метода с использованием идеального индикаторного ИСЭ принадлежит Мейтесу с сотр. [89—91]. Авторы показали, что эффект разбавления приводит к отклонению точки перегиба кривой титрования от точки эквивалентности. Однако, как было продемонстрировано в работах [23, 24, 140, 141] на примере осадительного и комплексонометрического титрования с ионометрическим контролем за ходом титрования, влияние этого эффекта на погрешность результатов определения мало по сравнению с помехами в отклике электрода и погрешностями, связанными с невысоким значением константы равновесия реакции титрования. [c.131]
Слайд 1
Осадительное титрование
Тиранты образуют с определяемым веществом малорастворимое соединение
Требования к реакциям:
1.
Определяемое вещество должно х.р. в воде и содержать ион, образующий
с титрантом малорастворимое соединение

Слайд 2
2. Реакция осаждения должна протекать стехиометрично
3. Не должно протекать побочных
реакций
4. Реакция должна протекать практически до конца
ПР
осадка ВА,
ПР<4·10–12 для осадков типа В2А или ВА2

Слайд 3Классификация методов осадительного титрования:
1. Аргентометрия (тирант — AgNO3)
2. Тиоцианатометрия (NH4SCN)
3.
Меркурометрия (Hg2(NO3)2)
4. Гексацианоферратометрия (K4[Fe(CN)6])
5. Сульфатометрия (H2SO4)
6. Бариметрия (BaCl2)
![Осадительное титрование
Тиранты образуют с определяемым веществом Классификация методов осадительного титрования:1. Аргентометрия (тирант - AgNO3)2. Тиоцианатометрия (NH4SCN)3. Меркурометрия Классификация методов осадительного титрования:1. Аргентометрия (тирант - AgNO3)2. Тиоцианатометрия (NH4SCN)3. Меркурометрия (Hg2(NO3)2)4. Гексацианоферратометрия (K4[Fe(CN)6])5. Сульфатометрия (H2SO4)6. Бариметрия](https://theslide.ru/img/thumbs/3dc75d9771173f99750f51206e309bc3-800x.jpg)
Слайд 4Аргентометрия
Титрант – 0,1 или 0,05 моль/л раствор AgNO3
Готовят раствор
приблизительно нужной концентрации
Стандартизацию проводят по хлориду натрия
(метод Мора)
Ind
– хромат калия K2CrO4

Слайд 5
Разновидности аргентометрии
метод Мора
метод Фаянса
метод Фольгарда

Слайд 6Метод Мора
Основан на определении Cl и Br прямым титрованием раствором
нитрата серебра в нейтральной или слабощелочной среде в присутствии индикатора
– хромата калия
Метод не позволяет определять I и SCN ионы, так как с осадками AgI и AgSCN происходит соосаждение хромата калия Ag2CrO4

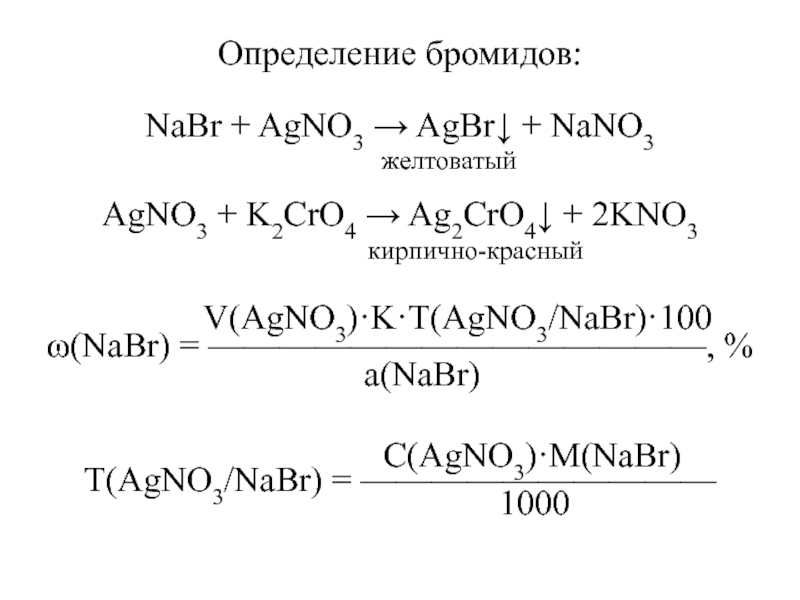
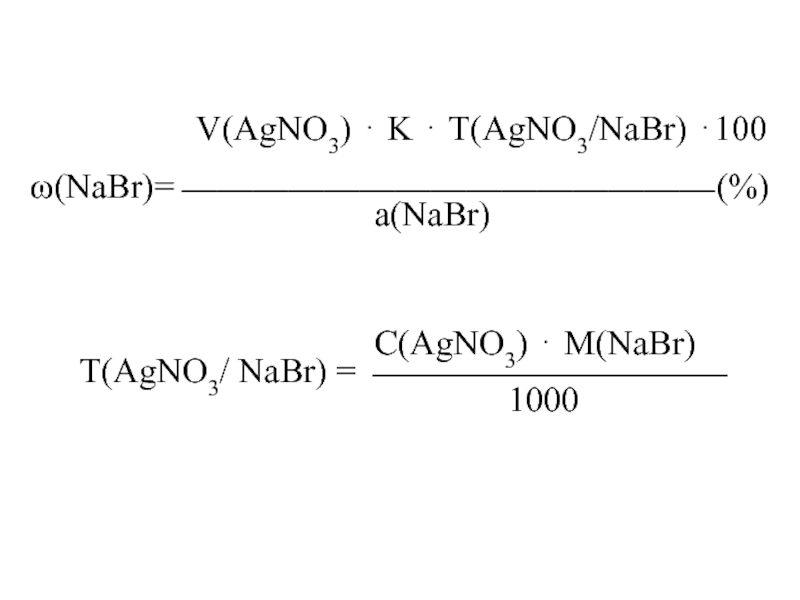
Слайд 7Определение бромидов:
NaBr + AgNO3 AgBr + NaNO3
желтоватый
AgNO3 + K2CrO4 Ag2CrO4 + 2KNO3
кирпично-красный
V(AgNO3)·K·T(AgNO3/NaBr)·100
(NaBr) = ——————————————, %
а(NaBr)
С(AgNO3)·M(NaBr)
Т(AgNO3/NaBr) = ——————————
1000
Слайд 8Ind – K2CrO4 (осадительный)
Осадительные индикаторы выделяются из раствора в виде
осадка в хорошо заметной форме в ТЭ или вблизи ее.
В
процессе титрования:
образуется желтоватый AgBr
Ag2CrO4 до ТЭ не образуется, т.к.
S(AgBr)< S(Ag2CrO4)
При добавлении избыточной капли AgNO3 образуется красный осадок Ag2CrO4

Слайд 9Особенности метода Мора:
1. Титрование проводится в нейтральной или слабощелочной среде
(рН=6,5-10,3), т.к.
В кислой среде Ag2CrO4 растворяется с образованием дихромат-ионов:
2 Ag2CrO4
+ 2H+ 4Ag+ + Cr2O7– + H2O
В щелочной среде образуется черный осадок
2Ag+ + 2OH– 2AgOH Ag2O + H2O

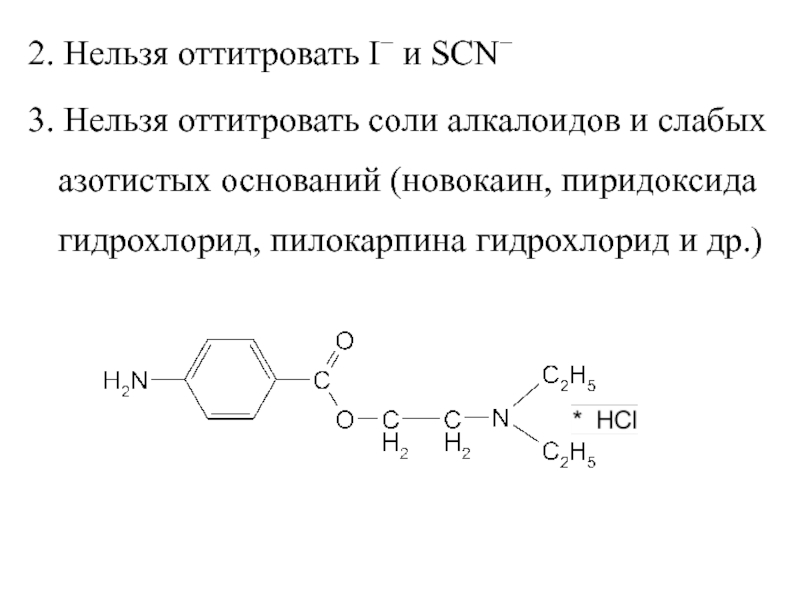
Слайд 102. Нельзя оттитровать I и SCN
3. Нельзя оттитровать соли алкалоидов
и слабых азотистых оснований (новокаин, пиридоксида гидрохлорид, пилокарпина гидрохлорид и
др.)
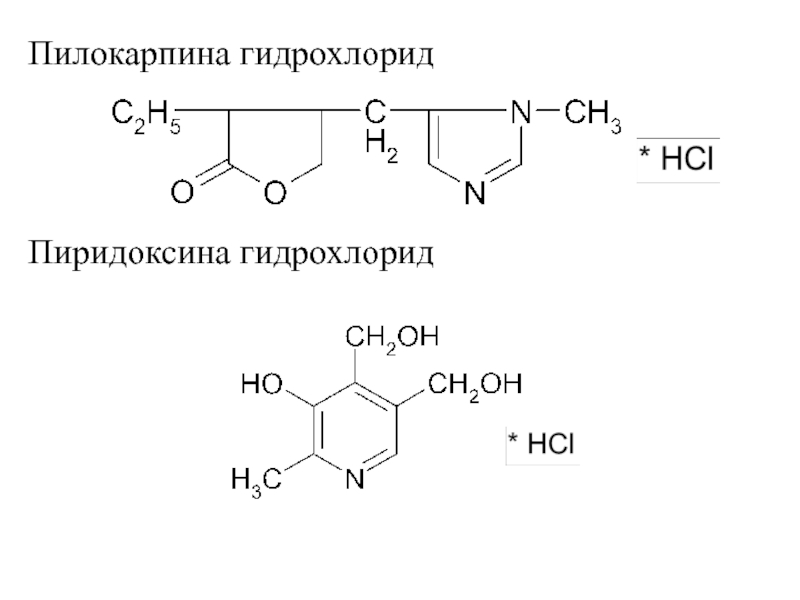
Слайд 11Пилокарпина гидрохлорид
Пиридоксина гидрохлорид
Слайд 12
V(AgNO3) K Т(AgNO3/NaBr) 100
(NaBr)= (%)
а(NaBr)
С(AgNO3) М(NaBr)
Т(AgNO3/ NaBr) =
1000
Слайд 13Метод Фаянса
Основан на определении Cl , Br , I
и SCN ионов прямым титрованием раствором нитрата серебра в присутствии
адсорбционных индикаторов (флуоресцеин, эозинат натрия, бромфеноловый синий и др. индикаторы).

Слайд 14
Адсорбционные индикаторы – такие индикаторы, адсорбция или десорбция которых осадком
при осадительном титровании сопровождается изменением окраски в ТЭ или вблизи
ее

Слайд 15
Титрование по флуоресцеину проводят в растворах с рН от 6,5
до 10,3 (определяют Cl, Br, I, SCN)
Титрование по эозинату
натрия проводят при рН от 2 до 10,3, чаще в уксуснокислой среде (определяют Br, I, SCN).
Cl по эозинату натрия не определяют, так как осадок хлорида серебра адсорбирует анионы эозина еще до достижения точки эквивалентности.

Слайд 16Определение иодидов:
NaI + AgNO3 AgI + NaNO3
желтый
Принцип действия адсорбционных индикаторов
HInd H+ +
Ind
[AgI · I] [AgI] [AgI · Ag+]
до т.э. т.э. + 1 изб.
капля Ind
цвет индикатора меняется

Слайд 17Вначале титрования:
В растворе иодид-ионы
До ТЭ:
Осадок AgI и I . Иодид-ионы
адсорбируются на поверхности осадка AgI и поверхность осадка оказывается отрицатльно
заряженной (осадки адсорбируют в первую очередь те ионы, которые входят в их состав). Около поверхности осадка находятся катионы, присутствующие в растворе: Na+, H+

Слайд 18ТЭ:
осадок AgI.
За ТЭ:
осадок AgI и Ag+. Ионы серебра
адсорбируются на поверхности осадка и поверхность осадка оказывается заряженной положительно
и на ней сразу же адсорбируются отрицательно заряженные ионы индикатора. Происходит изменение цвета осадка.

Слайд 19Условия применения адсорбционных индикаторов:
1. Нельзя проводить титрование при больших концентрациях
реагентов и при повышенной ионной силе растворе, т.к. это вызывает
коагуляцию осадка и сокращению его поверхности. Чем больше поверхность осадка, тем отчетливее заметно изменение цвета индикатора при его адсорбции.

Слайд 20
2. Следует соблюдать оптимальный интервал изменения рН раствора
3. Индикатор не
должен адсорбироваться на поверхности осадка раньше определяемых ионов

Слайд 21Адсорбционная способность анионов при рН=7 на поверхности осадка AgCl
I– >
SCN– > Br– > анион эозина > Cl– >анион флуоресцеина
> ClO4–
Каждый предшедствующий анион этого ряда адсорбируется на поверхности осадка AgCl раньше последующего аниона, т.е.
В присутствии эозина можно определить I–, SCN–, Br– и нельзя определить Cl– и ClO4–

Слайд 22
V(AgNO3) K
Т(AgNO3/NaI) 100
(NaI)= (%)
а(NaI)
С(AgNO3) М(NaI)
Т(AgNO3/NaI) =
1000

Слайд 23Метод Фольгарда
Метод обратного титрования.
Титранты – AgNO3 и AgSCN
Среда
– азотнокислая
Ind – железоаммонийные квасцы NH4Fe(SO4)212H2O (сильнокислая среда подавляет
гидролиз соли железа (III))
Определяют Cl , Br , I

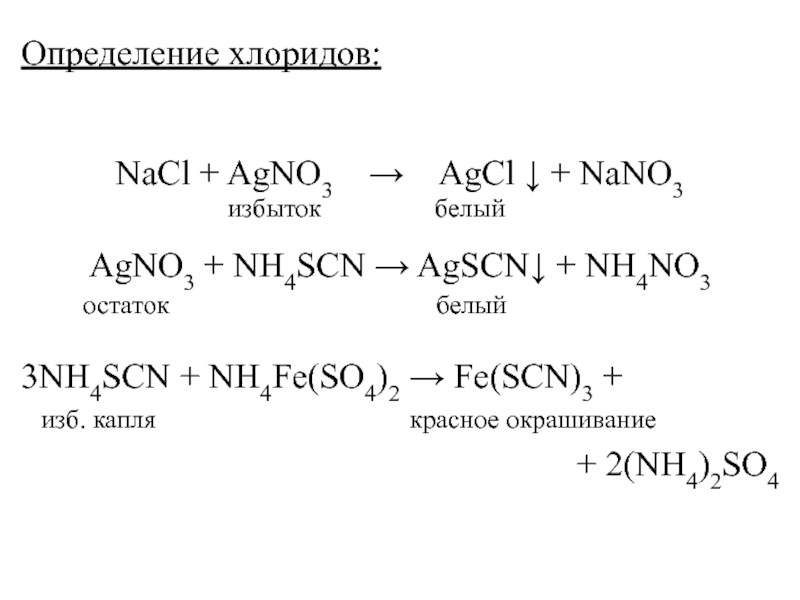
Слайд 24Определение хлоридов:
NaCl + AgNO3 AgCl +
NaNO3
избыток белый
AgNO3 + NH4SCN AgSCN + NH4NO3
остаток белый
3NH4SCN + NH4Fe(SO4)2 Fe(SCN)3 +
изб. капля красное окрашивание
+ 2(NH4)2SO4
Слайд 25Особенности определения хлоридов
т.к. SAgCl > SAgSCN
осадок AgCl удаляют:
либо
фильтрованием
либо добавлением хлороформа

Слайд 26
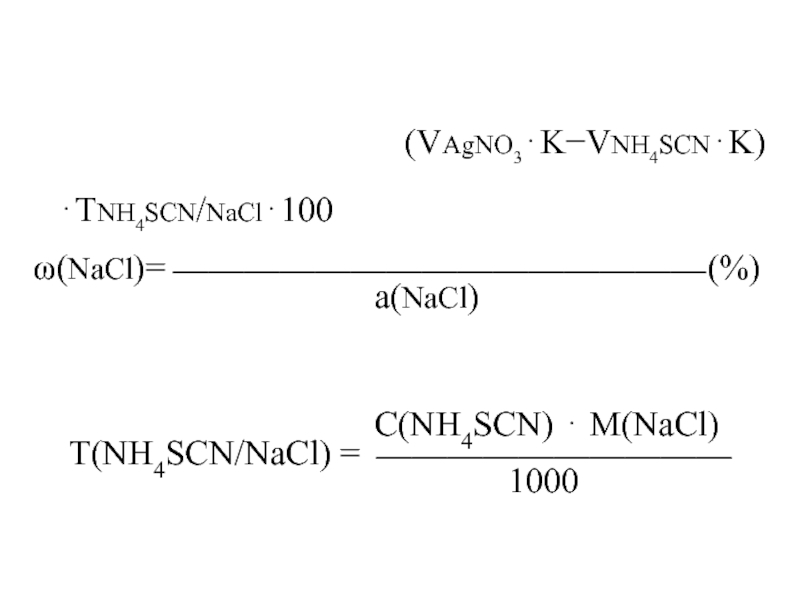
(VAgNO3KVNH4SCNK)ТNH4SCN/NaCl100
(NaCl)= (%)
а(NaCl)
С(NH4SCN) М(NaCl)
Т(NH4SCN/NaCl) =
1000
Слайд 27
В фарм. анализе аргентометрия применяется для количественного определения лекарственных препаратов:
NaCl, NaBr, NaI, KCl, KBr, KI, солей алкалоидов, слабых азотистых
оснований и др.

Слайд 28Роданометрия
Титрант – 0,1 моль/л раствор NH4SCN
Среда – азотнокислая
Ind – NH4Fe(SO4)212H2O
Стандартизация по стандартному р-ру AgNO3
AgNO3 + NH4SCN AgSCN +
NH4NO3
белый
3NH4SCN + NH4Fe(SO4)2 Fe(SCN)3 +
красное окрашивание
2(NH4)2SO4

Слайд 29
В фарманализе метод применяется для к.о. серебра в препаратах (протаргол,
колларгол, нитрат серебра).
В протарголе и колларголе серебро предварительно переводят
в ионогенное состояние обработкой серной и азотной кислотой при нагревании.
В полученном растворе ионы серебра оттитровывают стандартным раствором роданида аммония.

Слайд 30МЕРКУРОМЕТРИЯ
Титрант – 0,05 моль/л раствор нитрата ртути(I)
Hg2(NO3)2 (молярная концентрация
эквивалента 0,1 моль/л)
Готовят приблизительно нужной концентрации
Для перевода Hg(II) в Hg(I) добавляют металлической ртути, выдерживают сутки
Стандартизация по хлориду натрия
Ind – дифенилкарбазон, тиоцианатные комплексы железа(III)

Слайд 31
2NaCl + Hg2(NO3)2 Hg2Cl2 + 2NaNO3
В титруемый раствор вводят
NH4SCN и Fe(NO3)3 – образуется красный комплекс Fe(SCN)3
После достижения
ТЭ, избыточная капля титранта разрушает Fe(SCN)3, раствор обесцвечивается
Параллельно проводят контрольный опыт

Слайд 32
Дифенилкарбазон (C6H5NHNH)2CO – адсорбционный индикатор
Добавляется в конце титрования
Вблизи ТЭ индикатор
окрашивает осадок в интенсивный синий цвет

Слайд 33
Кривые
осадительного титрования
Отражают зависимость концентрации вещества от объема титранта
Концентрацию вещества выражают
через обратный логарифм (по аналогии с рН).

Слайд 34
Рассчитать и построить кривую титрования 0,1 н раствора NaCl
0,1 н раствором AgNO3 ПРAgCl = 1,810-10
Построим кривую титрования в
координатах «концентрация хлорид-ионов» — «объем титранта»
При этом концентрацию хлорид ионов выразим через pCl = –lg [Cl–].

Слайд 35Расчетные ф-лы в разные моменты титрования:
1) до начала титрования концентрация
Cl– равна концентрации NaCl:
[Cl–] = CNaCl; pCl = –lg CNaCl;
2) до точки эквивалентности [Cl–] = CNaCl (1 – f), где f – степень оттитровывания (показывает, какая часть анализируемого вещества оттитрована)
Тогда pCl = –lg CNaCl(1 – f)
Если оттитровано 30 %, то f = 30 / 100 = 0,3
50 % f = 50 / 100 = 0,5
90 % f = 90 / 100 = 0,9

Слайд 363) в т.э. концентрацию вещества вычисляют из произведения растворимости осадка.
[Cl–] = ПР рCl
= – ½ lg ПРAgCl
4) за т.э. [Cl–] рассчитывают из ПРAgCl , учитывая возрастание концентрации Ag+ с помощью степени оттитрованности f:
[Cl–] = ПР / [Ag+] = ПР / CAgCl(f – 1) рCl = –lg ПРAgCl + lg CAgCl(f – 1)
![Осадительное титрование
Тиранты образуют с определяемым веществом 3) в т.э. концентрацию вещества вычисляют из произведения растворимости осадка. 3) в т.э. концентрацию вещества вычисляют из произведения растворимости осадка. [Cl–] = ПР](https://theslide.ru/img/thumbs/1cf20898dcc40042738c0dee8094828b-800x.jpg)
Слайд 38Скачок титрования
рХ = рХ100,1 – рХ99,9 = -lgПР –
3 + lgС – 3 + lgC = -lgПР –
6 + 2lgС
Cкачок титрования зависит от ПР и концентрации анализируемого вещества
Чем меньше ПР, тем больше рХ
Чем больше концентрация, тем большерХ

Слайд 39
Скачок титрования лежит в интервале 4 – 6
При индикаторной фиксации
ТЭ выбирают индикатор, который резко меняет свои видимые свойства в
данном интервале

Слайд 40Индикаторная ошибка осадительного титрования обусловлена перетитровыванием раствора и равна:
n(T) 100
X% = —————
n(T)
n(T) – избыточное количество титранта в конечной точке титрования
n(T) – количество титранта в точке эквивалентности

Слайд 41
СT (VX +
VT)
X% = ———————— 100
СT VT
СT – концентрация титранта в конечной точке титрования
СT – исходная концентрация титранта
VT – объем титранта
VX – объем анализируемого раствора
Концентрация ионов титранта в к.т.т рассчиты-вается из значения ПР осадка титранта с Ind

Слайд 42
Рассчитать индикаторную ошибку при титровании 10 мл 0,1 н раствора
хлорида калия 0,1 н раствором нитрата серебра в присутствии индикатора
– 10-5 моль/л хромата калия

Слайд 43
СT (VX + VT)
X% = ———————— 100
СT VT
ПР(Ag2CrO4) = [Ag+]2[CrO42–] = 1,110–12
ПР(Ag2CrO4) 1,110–12
[Ag+] = ——————— = ——————— =
[CrO42–] 10-5
= 3,310–4 моль /л
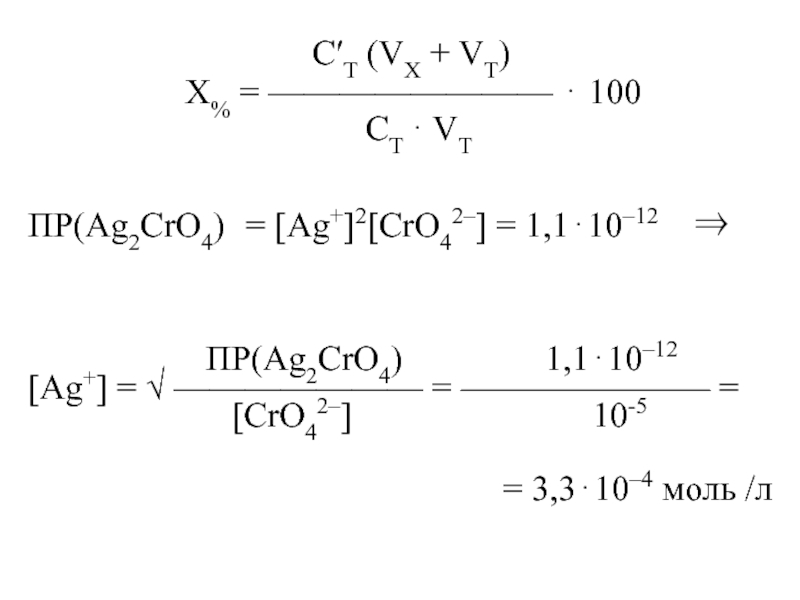
Слайд 44
3,310–4 (10 +
10)
X% = ——————— 100 = 0,66 %
0,1 10
Ошибка велика, целесообразно увеличить концентрацию индикатора
Тогда для концентрации индикатора 10–3 моль/л ошибка титрования составит:
3,310–5 (10 + 10)
X% = ——————— 100 = 0,066 %
0,1 10

Индикаторная ошибка — титрование
Cтраница 1
Индикаторная ошибка титрования вычисляется аналогично ошибке в осадительном титровании. Для этого нужно знать концентрацию взятого для титрования [ Me ], [ Me ] в точке эквивалентности, которая вычисляется на основании константы устойчивости комплекса с ЭДТА при данном рН и [ Me ] в момент, когда индикатор меняет окраску. Эта величина вычисляется с использованием константы устойчивости комплекса металла с индикатором.
[1]
Индикаторной ошибкой титрования называют погрешность, которая вызывается несовпадением показателя титрования, используемого индикатора с41 величиной рН в точке эквивалентности.
[3]
Индикаторной ошибкой титрования называют погрешность, которая вызывается несовпадением показателя титрования используемого индикатора с величиной рН в точке эквивалентности.
[4]
При вычислении индикаторной ошибки титрования используют эти же формулы, но неизвестной величиной будет являться концентрация соответствующей кислоты ( основания) или соли.
[5]
Эту погрешность называют индикаторной ошибкой титрования.
[6]
Таким образом, возможны четыре индикаторные ошибки титрования в методе нейтрализации: водородная, гидроксильная, кислотная и щелочная.
[7]
Имеется полная аналогия в вычислении индикаторных ошибок титрования в кислотно-основном и осацительном титровании.
[8]
Как уже было указано, индикаторной ошибкой титрования является погрешность, которая обусловлена несовпадением показателя титрования применяемого индикатора с величиной рН в точке эквивалентности. При этом различают четыре основных типа индикаторных ошибок.
[9]
Выше было показано, как путем вычисления индикаторной ошибки титрования решать вопрос о пригодности какого-либо заранее заданного индикатора. Если же индикатор не указан, то выбирают такой, показатель титрования которого возможно ближе подходит к величине рН в точке эквивалентности ( находимой по известным формулам), и вычисляют для него индикаторную ошибку титрования.
[10]
Выше было показано, как путем вычисления индикаторной ошибки титрования решается вопрос о пригодности какого-либо заранее заданного индикатора.
[11]
Выше было показано, как путем вычисления индикаторной ошибки титрования решается вопрос о пригодности какого-либо заранее заданного индикатора.
[12]
Таким образом, по Бьерруму, возможны четыре индикаторные ошибки титрования в методе нейтрализации: водородная, гидро-ксильная, кислотная и щелочная.
[13]
Чтобы окраска окислительно-восстановительного индикатора изменялась при титровании резко и индикаторная ошибка титрования была незначительной, необходимо, чтобы область перехода индикатора находилась в пределах скачка потенциалов на кривой титрования.
[14]
Страницы:
1
2
3
Расчет индикаторных погрешностей кислотно-основного титрования
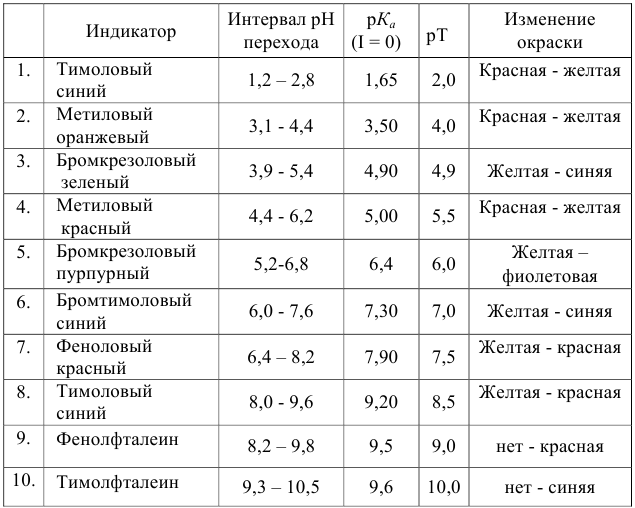
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 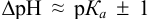
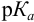
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 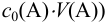
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
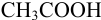
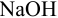
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
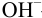
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 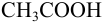



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 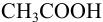
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 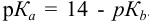
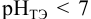
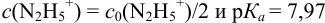
Сравнивая рТ индикаторов и 
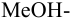
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 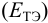

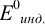
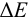
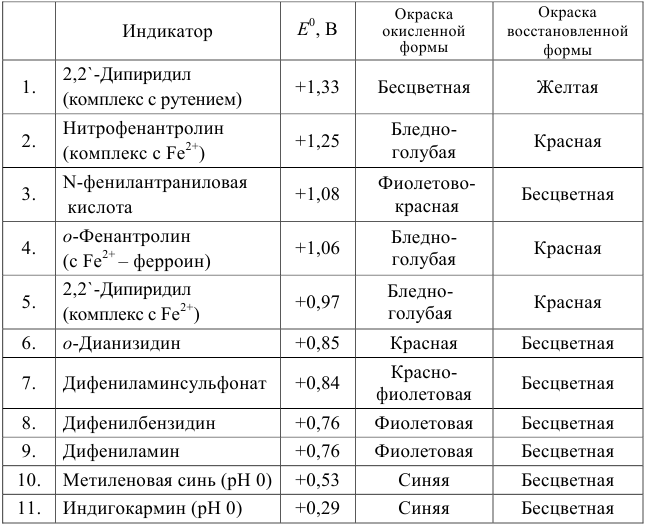
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 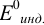
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 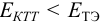
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 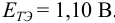
Выберем для рассмотрения порядка расчета два индикатора:
а) с 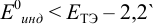
б) с 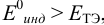
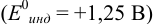
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
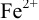



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

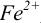
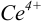
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 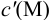
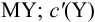
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 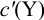
Вблизи ТЭ 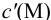
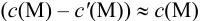
следовательно:
Выражение (8.21) тождественно выражению: 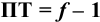
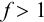
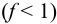
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
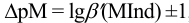
Интервал перехода окраски 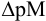
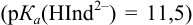
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 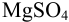

Решение:
В данных условиях 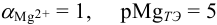
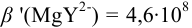
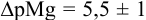
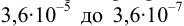

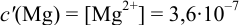
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 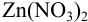

Решение:
1. Рассчитаем условную константу 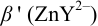
Общие константы устойчивости для аммиачных комплексов 
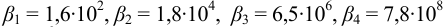

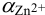
По табл. 7 и табл. 4 приложения находим 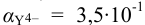
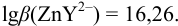

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 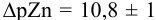
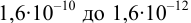

2. Конечная точка титрования наступает при [
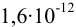

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:




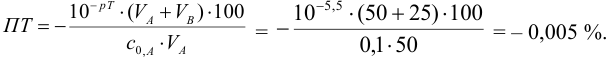
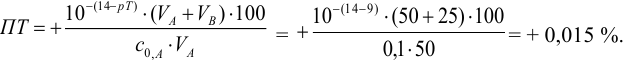
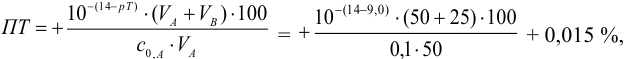
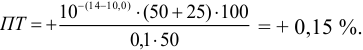
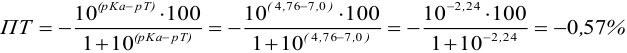
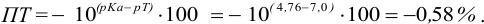
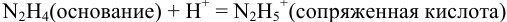
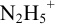
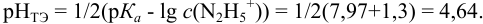
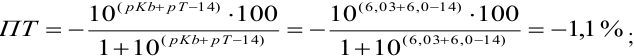
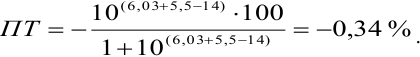

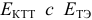 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.