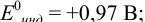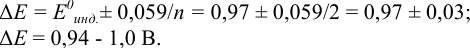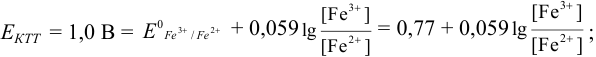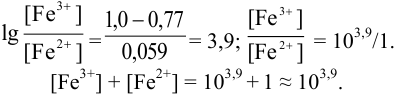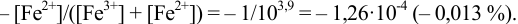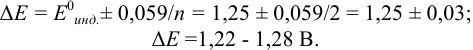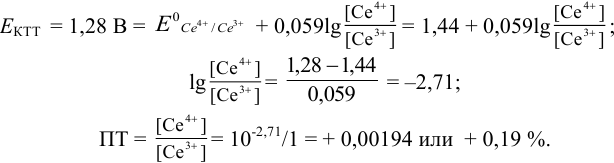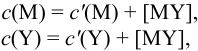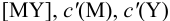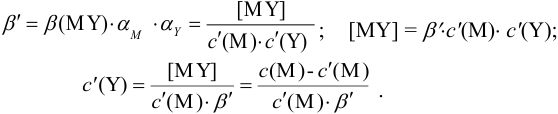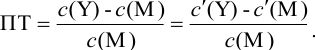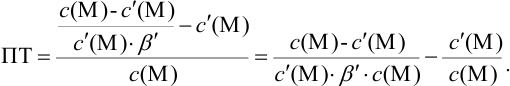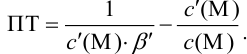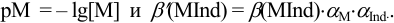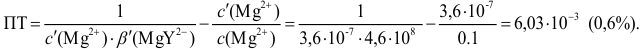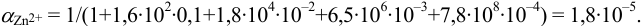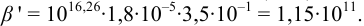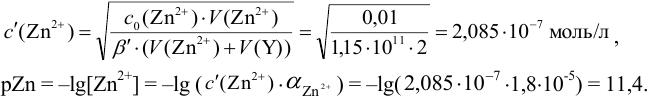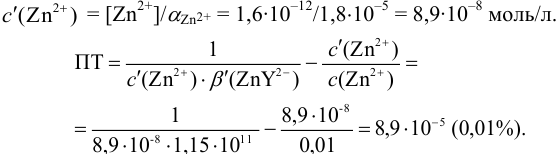В протолитометрии
различают 4 вида индикаторных
ошибок: водородная, гидроксильная,
кислотная и основная.
-
Водородная
(Н+) ошибка
возникает при титровании сильных
электролитов (сильное – сильное)
и обусловлена избытком протонов в
растворе. Эта ошибка имеет место, если
сильная кислота
недотитрована, а сильное основание
– перетитровано. -
Гидроксильная
(ОН–) ошибка
также характерна для титрования
системы сильное – сильное и возникает
при избытке гидроксо—групп
в растворе. Сильная кислота при этом
будет перетитрована, а сильное
основание – недотитровано. -
Кислотная
ошибка проявляется при титровании
слабой кислоты сильным основанием,
в том случае, когда слабая кислота
недотитрована и в растворе избыток
протонов. -
Основная ошибка
характеризует систему слабое
основание
сильная кислота в момент, когда
слабое основание недотитровано, т.е.
при избытке в растворе гидроксо-групп.
Так как при
титровании слабых электролитов в
качестве титранта обычно используют
сильный электролит (щелочь или кислоту),
то в перетитрованном растворе
избыток титранта создает погрешность
1-го или 2-го типа: водородную или
гидроксильную ошибку.
Главным критерием
применимости того или иного индикатора
является значение индикаторной ошибки,
которая не должна превышать 0,5%. Если
погрешность выше, то такой индикатор
применять нельзя.
4.3. Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая
характеристика каждого титриметрического
метода включает наиболее существенные
его особенности: приготовление и свойства
рабочих растворов, виды кривых титрования,
погрешности определения, способы
индикации точки эквивалентности и
практическое применение. На основании
этого все методы титрования
классифицируют
по 2-м признакам: типу
реакции,
лежащей в основе
метода
и способу проведения анализа.
Каждый вид титрования имеет свои
особенности и закономерности и может
осуществляться различными способами.
Как видно из схемы (рис. 4.9), в зависимости
от типа
реакции,
лежащей в основе метода, различают 4-ре
вида
титрования:
-
кислотно-основное
или метод нейтрализации (протолитометрия); -
окислительно-восстановительное
(редоксиметрия); -
комплексометрическое;
-
осадительное
(метод седиментации).

Рисунок
4.9 – Классификация методов титрования
в соответствии с типом химической
реакции (где L
– комплексный ион; МеL
– образовавшийся комплекс; А – осаждаемое
вещество, В – титрант, АВ – осадок).
4.3.1 Способы титрования.
Так как напрямую,
реакцией с титрантом, можно анализировать
далеко не любое вещество, особенно, если
оно неустойчиво на воздухе, то для
решения подобных задач было разработано
несколько приемов
(способов)
проведения анализа. Они
позволяют заменять неустойчивые,
в данных условиях соединения,
на эквивалентное количество более
устойчивого, которое не подвергается
гидролизу или окислению. Известны
следующие основные способы
проведения титриметрического анализа:
-
прямое
титрование; -
реверсивное;
-
обратное титрование
или титрование по остатку; -
косвенное
титрование или по замещению (по
заместителю).
В таблице 4.1 показаны
области применения различных способов
в зависимости от вида титрования.
Таблица 4.1 –
Применение различных видов и способов
титрования.
|
название метода |
частное название метода; (рабочий раствор) |
вещества, |
||
|
прямым |
обратным |
косвенным |
||
|
Протолито-метрия |
Ацидиметрия
(кислоты: |
основания;
соли, образован-ные сильным |
соли слабых оснований и сильных кислот; органические соединения |
|
|
Алкалиметрия
(щелочи: |
кислоты;
соли, образован-ные слабым |
|
|
|
|
Редокси-метрия |
Перманганато-метрия |
восстановители |
окислители |
вещества, реагирующие с восстанови-телями |
|
Иодометрия
( и |
восстановители |
восстановители |
окислители; кислоты |
|
|
Комплексо-метрия |
Комплексоно- метрия (ЭДТА) |
катионы, образующие с ЭДТА комплексы |
катионы в водо-нерастворимых катионы,
для которых отсутствует |
катионы, образующие с ЭДТА |
|
Метод |
Аргентометрия
( |
Анионы, образую-щие с |
катионы, образующие |
|
Рассмотрим подробнее
суть различных способов титрования.
1. Прямое
титрование заключается в
непосредственном взаимодействии
титранта и титруемого вещества. В
процессе титрования к аликвоте или
навеске вещества постепенно добавляют
раствор титранта, объем которого точно
фиксируют в Т. Э. В качестве титранта
используют рабочий раствор известной
концентрации. Расчет содержания вещества
в образце выполняют по закону эквивалентов:
=
(4.1)
где
– количество моль-эквивалентов
анализируемого вещества в титруемом
образце; а
количество
моль-эквивалентов титранта, вступившего
в реакцию с определяемым компонентом
А.
Концентрацию
компонента А в растворе вычисляют
по формуле:
(4.2)
где
– молярная концентрация эквивалента
(нормальность) титруемого раствора
(определяемого компонента), моль-экв/л;
– объем аликвоты титруемого раствора,
мл;
–
концентрация и
объем титранта в
точке эквивалентности. При титровании
методом отдельных навесок формула
(4.2) преобразуется в выражение (4.3):
(4.3)
Метод применяется
во всех случаях, когда нет каких-либо
ограничений. Например, при анализе
кислот, определении жесткости воды.
2. Реверсивное
титрование – это разновидность
прямого титрования, когда рабочий и
титруемый растворы меняют местами. В
этом случае для анализа отбирают
аликвоты рабочего раствора, а в Т.Э.
измеряют израсходованный на
титрование объем анализируемого
раствора. Вычисления проводят также,
как и в прямом титровании, по формулам
(4.2) или (4.3). Метод позволяет ограничить
площадь поверхности раствора,
контактирующей с воздухом, при
стандартизации относительно неустойчивых
соединений, как например NaOH.
Титрование по
заместителю (косвенное) и титрование
по остатку (обратное) основаны
на использовании вспомогательного
раствора, взаимодействующего с
определяемым компонентом. Такой прием
позволяет выполнять анализ химически
нестойких объектов или же при отсутствии
подходящего индикатора.
В косвенном
титровании сначала осуществляют
реакцию определяемого вещества
А со вспомогательным раствором
В, а затем титруют
эквивалентное количество
образовавшегося продукта реакции
С (заместитель). Этот способ
можно представить в виде схемы: А + В
С + (т-т) , исходя из которой запишем
выражение для закона эквивалентов:
=
=
.
(4.4)
Из равенства (4.4)
следует, что
=
и расчет можно также выполнять по
формулам (4.2) и (4.3), используемых для
прямого титрования. Для полноты реакции
вспомогательный раствор всегда берут
с небольшим избытком. Такой метод
титрования реализуется в йодометрии.
В обратном
титровании также сначала протекает
реакция между определяемым
веществом А и
взятым в избытке вспомогательным
раствором В, но затем титруют
остаток не прореагировавшего
вспомогательного раствора. Поэтому
необходимо точно знать концентрацию
вспомогательного раствора В и его
объем, взятый для анализа. Определение
компонента А выполняется согласно
схеме: А + В
Вост + (т-т). Исходя из
условий титрования, закон эквивалентов
можно записать в виде:
–
=
.
(4.5)
Откуда имеем:
=
.
(4.6)
Если все вещества
взяты в виде растворов, то формула (4.6)
примет вид
(4.7)
Если хотя бы одно
из веществ взято в сухом виде (известна
его масса), то следует воспользоваться
выражением (4.6) и записать значение
для каждого из веществ индивидуально.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 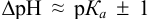
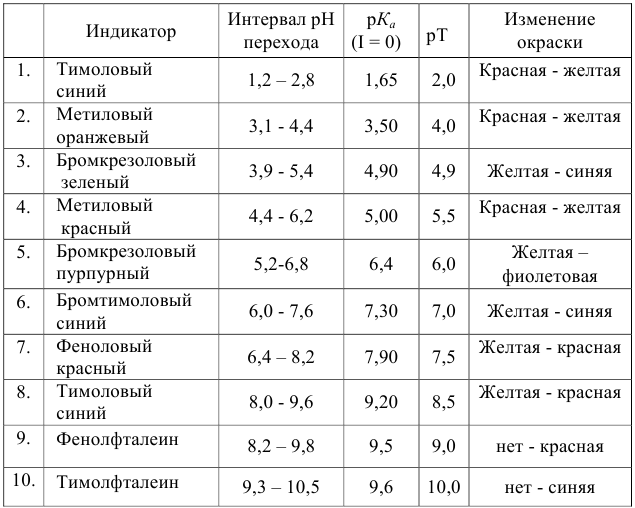
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 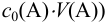
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
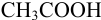
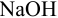
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
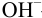
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 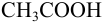



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 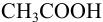
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 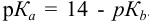
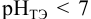
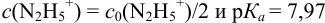
Сравнивая рТ индикаторов и 
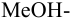
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 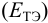

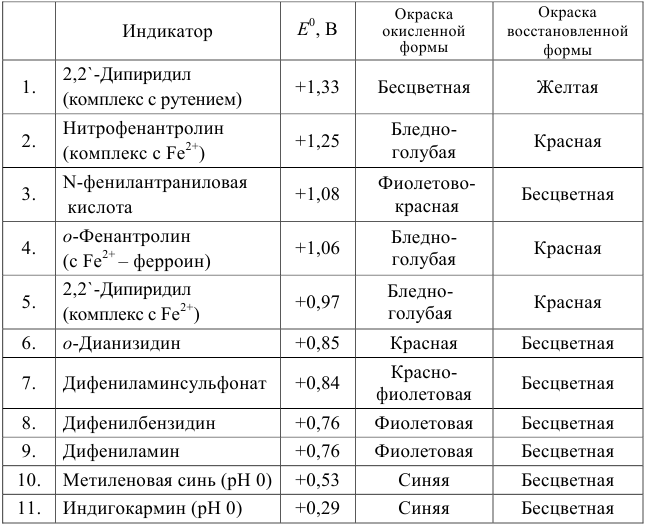
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 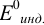
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 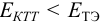
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 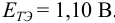
Выберем для рассмотрения порядка расчета два индикатора:
а) с 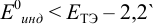
б) с 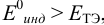
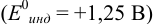
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
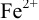



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

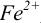
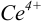
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 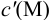
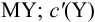
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 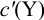
Вблизи ТЭ 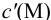
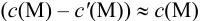
следовательно:
Выражение (8.21) тождественно выражению: 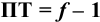
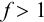
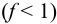
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
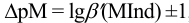
Интервал перехода окраски 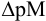
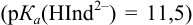
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 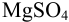

Решение:
В данных условиях 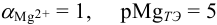
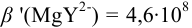
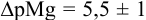
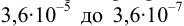

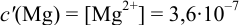
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 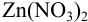

Решение:
1. Рассчитаем условную константу 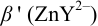
Общие константы устойчивости для аммиачных комплексов 
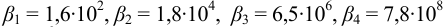

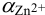
По табл. 7 и табл. 4 приложения находим 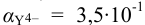
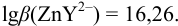

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 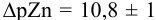
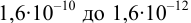

2. Конечная точка титрования наступает при [
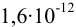

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
При кислотно-основном титровании, как и при других методах объемного анализа (см. 72), наиболее важными источниками ошибок являются отклонение рТ индикатора от pH в точке эквивалентности, а также недостаточная резкость изменения pH вблизи точки эквивалентности. Эти ошибки можно учесть различными способами, для чего предложен ряд формул и методов. Рассмотрим некоторые основные положения теории ошибок кислотно-основного титрования. [c.319]
В 56 было показано, что точка эквивалентности может находиться в нейтральной, кислой или щелочной средах в зависимости от природы титруемых веществ. Для того чтобы правильно выбрать индикатор, нужно знать, как изменяется pH в процессе титрования, вблизи точки эквивалентности, какое значение pH имеет раствор в точке эквивалентности. Чтобы ответить на все эти вопросы прибегают к расчету и построению кривых титрования./Кривые титрования в методе кислотно-основного титрования являются графическим изображением изменения pH раствора при постепенном прибавлении рабочего раствора к определенному количеству исследуемого раствора., Для упрощения вычислений (что не приводит к заметным ошибкам) обычно не учитывают [c.256]
В заключение коротко остановимся на вычислении ошибок тнтрования в методах осаждения. Их вычисляют так же, как ошибки титрования в методах кислотно-основного титрования. Предположим, Ад+-ион титруют с индикатором, чувствительность которого к этому иону отвечает концентрации а, выраженной в грамм-эквивалентах на 1 л. Если объем раствора в конце титрования (в мл) равен V, то число грамм-эквивалентов Ag+ будет равно аУ/ 000. Можно принять, что это число эквивалентов Аё и отвечает ошибке титрования. Если первоначальный объем титруемого раствора составлял V мл и имел нормальность Ы, то общее число эквивалентов Ag которое было оттитровано, равно Л У/100. Отсюда ошибка титрования в процентах равна [c.329]
Ошибки титрования с кислотно-основными индикаторами [c.216]
Каково же разумное значение этого индекса Для наиболее распространенных титрований, в которых используют бюретки емкостью 50 мл и кислотно-основные индикаторы для нахождения конечной точки, объем может быть оценен с точностью до 0,1%, а pH — с точностью до единицы. Если индекс крутизны равен 10 ошибка при определении pH в единицу дает ошибку в 0,1% —как и при установлении объема. [c.141]
Окраска индикаторов метода кислотно-основного титрования меняется в определенном интервале значений pH часто не строго в точке эквивалентности, а с некоторыми отклонениями как в ту, так и в другую сторону. Эту погрешность называют индикаторной ошибкой титрования. [c.340]
Поскольку индикаторы сами являются кислотами или основаниями, их присутствие влияет на кислотность того раствора, в который они введены. Если содержание индикатора по отношению к главному компоненту раствора слишком велико, то pH может измениться существенно. Однако не это является основным источником ошибки при кислотно-основных титрованиях. В Примере [c.127]
Систематическая индикаторная ошибка. При кислотно-основном титровании значению pH в точке эквивалентности, так называемому показателю титрования, не всегда соответствует pH перехода окраски индикатора, выражаемого в виде показателя индикатора р/Снша- При этом возникает систематическая индикаторная ошибка Р. Ее определяют как разность между количеством С (моль/дм 3) титранта, добавляемого до перехода окраски индикатора, и Со титранта, необходимого для достижения точки эквивалентности [c.149]
Определение конечной точки в кислотно-основном титровании обычно основывается на резком изменении pH, наблюдаемом вблизи точки эквивалентности. Интервал, внутри которого проис-ходит изменение pH, различен для разных случаев титрования и определяется природой и концентрацией как титруемого вещества, так и титранта. Для выбора подходящего индикатора и определения ошибки титрования требуется знать изменение pH в процессе титрования. Необходимо, таким образом, знать, как строятся кривые титрования в кислотно-основном методе. [c.210]
Следовательно, если титруется основание и индикатор находится также в основной форме, то индикаторная ошибка положительная. Если титруется кислота в присутствии основной формы индикатора, то та же индикаторная ошибка будет отрицательной. При титровании кислоты или основания в присутствии кислотной формы индикатора ошибку, обусловленную появлением основной его формы, можно вычислить по уравнению [c.65]
Как и в кислотно-основном титровании, ошибка комплексонометрического титрования при визуальном фиксировании иерехода окраски индикатора слагается из трех основных составляющих [c.120]
Объемное определение двуокиси углерода основано на поглощении Og раствором NaOH или Ва(ОН)2 и титровании кислотой в присутствии кислотно-основного индикатора. При определении двуокиси углерода в карбонатных минералах этим методом получаются более или менее верные результаты — , при низком содержании ошибка достигает 1 %. [c.358]
Индикаторы обладают кислотно-основными свойствами, естесяг-венно, что они реагируют с титрантом или исследуемым раствором, внося определенную ошибку в результаты титрования. По зтой причине концентрация инцикатора в титруемом растворе должна быть не больше, чем это необходимо для наблюдения четкого изменения окраски раствора при постижении конечной точки титрования. Кроме этого нужно иметь в виду, что для одноцветных индикаторов появление окраски буцет зависеть от их концентрации, так как [c.79]
Грация в 10 раз превышает концентрацию др. формы, т.е. если отношение [InJ/[InJ = [НзС /Кщ равно 0,1 или 10. Изменение цвета И. отмечается в области рН = рК 1, к-рый наз. интервалом перехода И. Изменение наиб, отчетливо, когда [lnj = [1п ,] и К, = [НзО] , т.е. при pH = рК . Значение pH, при к-ром обычно заканчивается титрование, наз. показателем титрования рТ. И. для титрования подбирают таким образом, чтобы интервал перехода окраски ключал значение pH, какое должен иметь р-р в точке эквивалентности. Часто это значение pH не совпадает с рТ используемого индикатора, что приводит к т. наз. индикаторной ошибке. Если в к. т. т. остается избыток неот-титрованного слабого основания или к-ты, ошибка наз. соотв. основной или кислотной. [c.228]
Общий термин иидикаторнаи ошибка, применяемый в учебной литературе, объединяет, по существу, три вида ошибок химическую, визуальную (дискриминационную) и собственно индикаторную ошибки. Химическая ошибка обусловлена несовпадением pH (при кислотно-основном титровании), рМ (-lg[ i] — при комштексонометрическом титровании), р1 (-lg[ l ], -lg[Bг ]. 1ё[П — при аргентометрическом титровании) в конечной точке титрования и в точке эквивалентности. Визуальная ошибка обусловлена ограниченной способностью глаза оценивать интенсивность и цветность окраски. Индикаторная ошибка обусловлена взаимодействием индикатора с титрантом или титруемым веществом. [c.64]
Говоря о хемилюминесцентных индикаторах, отметим возможность передачи энергии возбуждения от молекулы такого индикатора на молекулу красителя, способного флуоресцировать в результате спектр люминесценции становится тождественным спектру флуоресценции красителя, возникающему при освещении этого красителя ультрафиолетовым светом . А. Н. Теренин это явление назвал сенсибилизированной оксилюминесценцией . Например, если окислять перманганатом калия силоксен в присутствии адсорбированного на нем родамина С или родаминсульфоната, или изохинолинового красителя, то появляется яркая люминесценция, характерная для указанных красителей в адсорбированном состоянии. Сенсибилизированную оксилюминесценцию, отличную по цвету свечения от хемилюминесценции индикатора, наблюдали при каталитическом окислении люминола в присутствии флуоресцеина. Л. Эрдеи — с сотрудниками применяли смесь люминола и флуоресцеина, а также люцегенина и флуоресцеина в качестве чувствительного индикатора для определения точки эквивалентности при кислотно-основном титровании мутных и окрашенных растворов. Ошибка титрования 0,1 н. растворов соляной кислоты и едкого натра составляет 0,1—0,2%. [c.135]
Индикаторная ошибка. Учет индикаторной ошибки зависит от условий титрования. Если концентрация индикатора в растворе не превышает 0,1% от концентрации титруемого вещества, то ошибка за счет взаимодействия индикатора с титрантом или титруемым веществом пренебрежимо мала и ее можно не учитывать. В тех же случаях, когда концентрация индикатора более 0,1% от концентрации титруемого протолита, индикаторная ошибка может оказаться соизмеримой с химической и ее необходимо учитывать. Знак и величина индикаторной ошибки зависят от используемой формы индикатора и от степени изменения цвета в конце титрования. Если кислотно-основная форма применяемого индикатора совпадает с формой титруемого соединения, то индикатор от-титровывается титрантом и положительная ошибка возрастает. Если индикатор находится в одинаковой форме с титрантом, то он реагирует с титруемым соединением и возникающая при этом ошибка будет отрицательной. [c.64]
1.
Индикаторные ошибки
кислотно-основного титрования
1
2.
Водородная ошибка возникает, когда
недотитрована сильная кислота,
перетитровано сильное или слабое основание
Водородная ошибка – отношение количества
ионов водорода n(H+) в конце титрования к
первоначально взятому количеству вещества
n(X)
n
(H+)к.т.
X(H+) = ———— · 100%
n(X)
2
3.
n(X) = Сэкв(Х) · V(X)
Сэкв(Х) – молярная концентрация эквивалента
первоначально взятого вещества
V(X) – объем первоначально взятого вещества
n(H+)к.т. = [H+]к.т.· Vк.т.
Vк.т. – объем в конце титрования
Vк.т. = V(X) + V(Т)
3
4.
+] · (V(X) + V(Т))
[H
к.т.
+
X(H ) = ——————————— · 100%
С(1/z Х) · V(X)
рНк.т. = рТInd
[H+]к.т = 10–рН = 10–рТ
–рТ · (V(X) + V(Т))
10
X(H+) = ————————— · 100%
Сэкв(Х) · V(X)
4
5.
Гидроксильная ошибка обусловлена наличием
гидроксид-ионов в конце титрования и возникает, когда недотитровано сильное основание,
перетитрована сильная или слабая кислота
n(OH–)к.т.
X(OH–) = ———— · 100%
n(X)
n(OH–)к.т = [OH–]к.т. · (V(X) + V(Т))
n(X) = Сэкв(Х) · V(X)
–]
[OH
·
(V
(X) + V(Т))
к.т.
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
5
6.
рНк.т. = рТInd
т.к. рН + рОН = 14
рОН = 14 – рН = 14 – рТ
[OH–] = 10–(14 – рТ) = 10рТ–14
рТ–14 · (V(X) + V(Т))
10
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
6
7.
Кислотная ошибка возникает, когда остается
недотитрованной слабая кислота
Кислотная ошибка – отношение концентрации
недотитрованной кислоты в конце титрования
к ее оттитрованной части
HA + KOH H2O + KA
[HA]к.т.
X(HA) = ———— · 100%
[A–]к.т.
Оттитрованная часть кислоты будет
определяться анионами соли
7
8.
HAк.т. H+к.т. + A–к.т.
[H+]к.т. · [A–]к.т.
Kк-ты = ———————
[HA]к.т.
[HA]к.т. [H+]к.т.
———=
———
[A–]к.т.
Kк-ты
[H+]к.т.
X(HA) = ———— · 100%
Kк-ты
8
9.
рНк.т. = рТInd
[H+]к.т = 10–рН = 10–рТ
Kк-ты = 10–рК
10–рТ
X(HA) = ———— · 100%
10–рКк-ты
X(HA) =10рКк-ты–рТ · 100%
9
10.
Основная ошибка возникает, когда остается
недотитрованным слабое основание
Основная ошибка – отношение концентрации
неоттитрованного основания в конце
титрования к его оттитрованной части
[BOH]к.т.
X(BOH) = ———— · 100%
[B+]к.т.
10
11.
Аналогично с кислотной ошибкой можно
показать
[BOH]к.т.
[OH–]к.т.
—————
=
—————
[B+]к.т.
Kосн
[OH–]к.т.
X(BOH) = ———— · 100%
Kосн
Т.к. [OH–]к.т. = 10рТ–14
Kосн = 10–рКосн
11
12.
10рТ–14
X(BOH) = ———— · 100%
10–рКосн
X(BOH) =10рКосн + рТ–14 · 100%
12
13.
Вычислить ошибку титрования 0,2 н. раствора
HCl 0,2 н. раствором NaOH с индикатором
метиловым оранжевым.
рТ(м/о) = 4
ошибка водородная
–рТ · (V(X) + V(Т))
10
X(H+) = ————————— · 100%
Сэкв(Х) · V(X)
–4 · (10 + 10)
10
X(H+) = ——————— · 100 = 0,1%
0,2 · 10
Индикаторная ошибка должна быть 0,1%
13
14.
Вычислить индикаторную ошибку титрования
0,2 н. раствора HCl 0,2 н. раствором NaOH с
индикатором фенолфталеином
рТ(ф/ф) = 9
ошибка гидроксильная
рТ–14 · (V(X) + V(Т))
10
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
9–14 · (10 + 10)
10
X(OH–) = ——————— · 100 = 0,01 %
0,2 · 10
14
15.
Вычислить ошибку титрования 0,1 н. раствора
муравьиной кислоты 0,1 н. раствором сильного основания с индикатором метиловым
красным
рТ(м/к) = 5
рК(HCOOH) = 3,76
рНт.э. = 7 + ½ рКк-ты + ½ lg Cсоли = 8,38
Раствор недотитрован ошибка кислотная
15
16.
X(HA) =10рКк-ты–рТ · 100%
X(HA) =103,76–5 · 100 = 5,7 %
Индикатор использовать нельзя.
16
17.
Чему равна ошибка титрования 0,1 н. раствора
аммиака 0,1 н. раствором HCl с индикатором
крезоловым пурпуровым
рТ(к/п) = 8
рК(NH4OH) = 4,75
рНт.э. = 7 – ½ рКосн – ½ lg Cсоли = 5,10
Раствор недотитрован ошибка основная
X(BOH) =10рКосн + рТ–14 · 100%
X(BOH) =104,75 + 8–14 · 100 = 5,6%
17



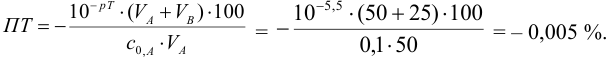
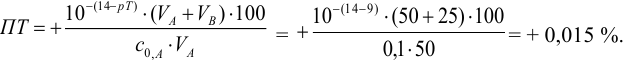
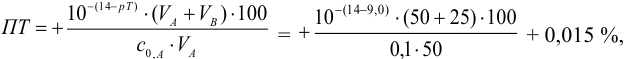
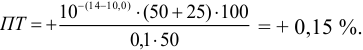
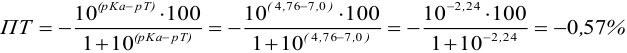
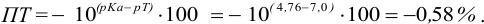
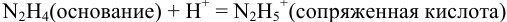
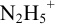
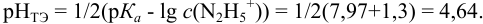
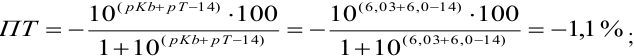
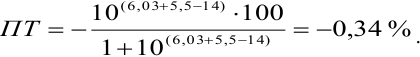

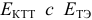 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.