Не всегда результат диагностического исследования в рамках проводимой биопсии оказывается точным, бывают ошибочные. Тому виной служит как человеческий фактор, так и другие причины, например, ошибка аппаратуры.
Ошибки в гистологии
В рамках малоинвазивной хирургии образцы тканей для последующего гистологического анализа могут быть получены различными методами.
Пункционный вид биопсии предполагает забор биоматериала при помощи трубки и иглы. Не всегда необходимый для точного анализа объем биопата попадает в шприц, что сказывается на достоверности результата. В этом случае не исключен повторный забор материала.
Если нет возможности удалить опухоль полностью, производится иссечение ее части. Результат диагностики и в этом случае может быть ошибочный, так как образец, попавший на анализ, может отличаться от основной массы и объема опухоли.
Полное удаление новообразование в данном случае – это точный метод диагностики.
Ошибки в биопсии и основные причины
Основными причинами ошибки в диагностике служат следующие факторы:
● место, где производится прокол, выбрано неправильно, что приводит к поверхностному забору биопата, который не сможет продемонстрировать клиническую картину течения заболевания;
● в связи с особенностью роста новообразования, из его очага невозможно забрать необходимое для точного исследования количества материала;
● несоблюдение правил, этапов приготовления, неправильная технология исследования забранного биоматериала;
● забор произведен с нарушениями, материал в дальнейшем хранился неправильно;
● неквалифицированный специалист, производивший забор биопата.
Не меньшую роль играет квалификация медика, который в дальнейшем анализирует собранный материал и интерпретирует полученные результаты лабораторных исследований.
Что еще влияет?
Если накануне забора материала пациент принимал определенные медикаменты, это также способно повлиять на конечный результат исследования.
Конечно, ошибки при исследовании биоптата на гистологию возникают не так часто. Это случаи исключительные, с минимальным процентом риска возникновения. То же можно сказать об ошибочной трактовке результатов исследования. Такой вариант не может влиять на итог всей диагностики заболевания.
28.09.2022
Пересмотр стекол
Москва,
Духовской переулок, 22Б
350015,
Краснодар,
Северная ул, 315
198035,
Санкт-Петербург,
Межевой канал, д.4, лит.А
603155,
Нижний Новгород,
Большая Печёрская ул., д.26
Обновлено: 06 июля 2022
61751
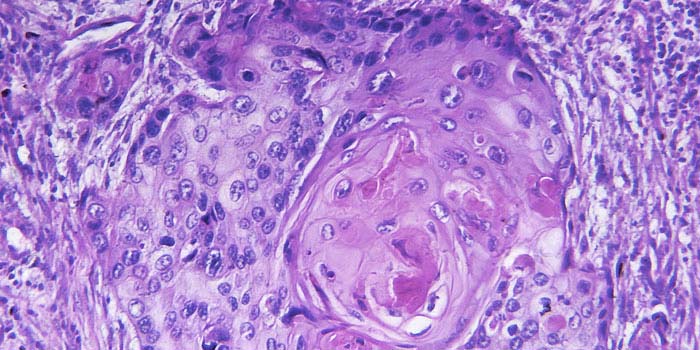
При онкологических заболеваниях материал опухоли берут для гистологического или цитологического исследования. Это необходимо для подтверждения диагноза и определения тактики дальнейшего ведения пациента.
Пересмотр гистологических стекол: опухолевая ткань
Полученный во время операции или на биопсии образец ткани (или клеточный материал) специальным образом фиксируют и окрашивают, чтобы изучить под микроскопом и иммуногистохимическими методами. Последние позволяют даже определить органопринадлежность опухоли. [1]
Что такое блоки и стекла?
Эти термины обозначают ткань, полученную во время биопсии и подготовленную особым образом. В первую очередь образцы заливают раствором формалина и проводят специальную обработку. Это нужно для того, чтобы зафиксировать материал, чтобы клетки не разрушились. Затем ткани необходимо придать нужную степень плотности. Для этого ее помещают в парафин – так получаются гистологические блоки.
Гистологические блоки, образец ткани помещен в парафин
Но и такие образцы пока еще не готовы к исследованию. Ткань в блоке нельзя рассмотреть под микроскопом, потому что она не пропускает свет, а слои клеток накладываются друг на друга. Чтобы ткань стала прозрачной и доступной для изучения, блок нужно нарезать на очень тонкие слои с помощью специального инструмента – микротома. Эти тоненькие слои помещают на стекла и фиксируют – получаются гистологические стёкла. [2,3]
Гистологические стекла
Если у пациента обнаружен рак, то лаборатория обязана хранить гистологические блоки пожизненно, а если патологии не выявлено – в течение пяти лет. Гистологические стекла при диагностированном онкологическом заболевании тоже хранятся пожизненно. Если нужно выполнить пересмотр, то можно обратиться в лабораторию, где проводилось исследование, и получить оба этих вида материала. [4]
Когда и почему необходим пересмотр стекол?
Если морфологическое заключение не соответствует клинической картине опухоли, а также снимкам МРТ или КТ, то стекла отправляют на пересмотр в другое лечебное учреждение. Обычно пересмотром стекол занимаются специалисты с многолетним стажем работы и уникальным опытом диагностики редких опухолей. Дополнительный ручной пересмотр исключает возможность ошибки, связанной с использованием автоматических анализаторов.
Почему могут возникать ошибки при первичном просматривании стекол?
- неправильный забор материала, например, захвачен не весь слой эпителия, и невозможно судить о глубине поражения;
- проведена биопсия участка здоровой ткани;
- некачественная обработка материала в лаборатории;
- малое количество изученных срезов;
- недостаточная квалификация патоморфолога. [5]
Качественное микроскопическое и иммуногистохимическое исследование позволяет начать оправданное и своевременное лечение опухоли, а значит, увеличивает шансы на излечение и выживаемость пациента при онкологических заболеваниях. Оптимально, если морфологический диагноз будет подтвержден двумя специалистами.
Список литературы:
- Tatyana S. Gurina; Lary Simms. Histology, Staining. Treasure Island (FL): StatPearls Publishing; 2021 Jan-.
- В. А. Корьяк, Л. А. Николаева. Основы гистологической техники. Учебное пособие.
- Гистологическое изучение микропрепаратов тканей и органов. Гистология, эмбриология, цитология. Под ред. д.м.н., доц. Н. Ю. Матвеевой. Владивосток, Медицина ДВ, 2015.
- Приказ МЗ РФ № 179н от 24.03.2016 г. «О правилах проведения патолого-анатомических исследований».
- P. Morelli, E. Porazzi, M. Ruspini, U. Restelli, and G. Banfi. Analysis of errors in histology by root cause analysis: a pilot study. J Prev Med Hyg. 2013 Jun; 54(2): 90–96.
Случай №28:

Случай №27:

Случай №26:

Случай №25:

Случай №24:


При подозрении на лимфопролиферативное заболевание гистологическое исследование должно дополняться иммуногистохимическим. Довольно часто диагноз, предполагаемый по результатам гистологического исследования, корректируется по итогам иммуногистохимии! Этот случай не стал исключением. К нам поступил материал с входящим диагнозом ангиоиммунобластная лимфома. Проведенные иммуногистохимические исследования привели к корректировке диагноза на доброкачественный — у пациента диагностирована болезнь Кастлемана.

Материал следующего пациента пришел к нам на исследование из Казахстана. Входящий диагноз — неходжкинская лимфома (нодальная B-клеточная лимфома маргинальной зоны). Для качественной постановки диагноза при подозрении на лимфопролиферативное заболевание требуется иммуногистохимическое исследование! Данный случай показателен, так как по результатам иммуногистохимии онкологический диагноз не подтвердился. Пациенту был поставлен диагноз — реактивная фолликулярная гиперплазия лимфоидной ткани.

Входящий гистологический диагноз — эпителиоидно-клеточная малопигментная меланома без изъязвления. После проведения пересмотра гистологии диагноз был изменен на эпителиоидноклеточный невус Шпитц. Этот тип доброкачественных образований часто вызывает сложности при дифференцировании его с меланомой ранней стадии, поэтому очень важно в этом случае проводить пересмотр гистологических стекол у патоморфолога, специализирующегося в данной области. Так как это доброкачественное образование, удаленное радикально, то пациенту не потребуется дополнительное лечение.
Случай №20:
Этот случай иллюстрирует необходимость проведения пересмотров гистологических стекол при первоначальной постановке злокачественного диагноза. К нам на исследование поступили материалы девушки 1987 г.р. с диагнозом рак яичника. По результатам пересмотра материалов нашими специалистами было вынесено другое заключение — серозная пограничная опухоль. Пациентке потребуется иное лечение, чем в случае злокачественной опухоли.
Случай №19:
Еще один случай из практики, наглядно показывающий необходимость проведения иммуногистохимических исследований для постановки точного диагноза. Материал поступил к нам со входящим диагнозом — фибромиксоидная саркома (злокачественное новообразование). Для постановки диагноза были проведены иммуногистохимические исследования. По результатам этих исследований был поставлен другой диагноз — плеоморфная фиброма (это доброкачественное образование).
Случай №18:
Этот случай иллюстрирует важность своевременного получения «второго мнения» высококвалифицированных специалистов. 
Случай №17:
Этот случай — еще одно подтверждение необходимости проведения иммуногистохимических 
Случай №16:
Опухоли центральной нервной системы часто представляют диагностическую сложность.
Случай №15:

Случай №14:
Клинический диагноз, с которым поступил материал 52-летней женщины, — B-клеточная лимфосаркома
Случай №13:
Поступил материал с входящим клиническим диагнозом — нейробластома. Проведены
Случай №12:
Входящий гистологический диагноз — анапластическая ганглиоглиома (GIII). По результатам
Случай №11:
Поступили материалы пациента 9 лет из Новокузнецка с подозрением на миксоидную
Случай №10:
Входящий клинический диагноз — рак предстательной железы. Пациент обратился за 

Мужчина 65 лет, Улан Удэ, входящий диагноз рак простаты, после простого пересмотра стекол нашими специалистами поставлен диагноз гиперплазия (не рак). Интересно в этом случае то, что это самый часто встречающийся вид рака у мужчин после 50.
Случай №8:
Входящий диагноз пациентки 25 лет из Иркутска — рак печени. Проведены иммуногистохимические исследования, материал оказался очень сложным в диагностике и был проконсультирован через систему Digital Pathology с профессором из Германии Дитером Хармсом, причем консультация заняла менее суток. Онкологический диагноз был изменен на доброкачественный — у пациентки аденома печени.

Поступил материал с подозрением на периферический рак нижней доли правого легкого. Исследованная ткань внутрилегочного лимфатического узла содержала признаки фолликулярной гиперплазии и антракоза. По итогам консультирования опухолевое поражение не было выявлено.
Случай №6:
Материалы поступили с подозрением на мелкоклеточную лимфому. По результатам проведенных гистологических и иммуногистохимических исследований установлено отсутствие опухолевого материала. Онкологический входящий диагноз был изменен на доброкачественную гиперплазию лимфоузла, вероятно вирусного генеза. Доброкачественная гиперплазия лимфоузлов часто требует для дифференцировки с лимфомами мнения патоморфолога, специализирующегося на данном типе онкологических заболеваний.
Случай №5:
Входящий клинический диагноз — системное заболевание лимфатических узлов шеи, 
Врач онколог, маммолог, хирург Алексей Галкин. Стаж 18+ лет. Принимает в Университетской клинике. Стоимость приема от 2000 руб.
Золотой стандарт для определения HER2 не установлен. Согласно ASCO/CAPs примерно 20% тестов HER2 могут быть неточными. К ним относятся преаналитические, аналитические и постаналитические переменные.
Причины неточностей анализа статуса HER2/neu
К таким преаналитическим переменным, которые влияют на производительность ИГХ или FISH относятся:
- время, необходимое для фиксации образца ткани;
- продолжительность его нахождения в растворе фиксатора;
- последующая обработка.
Такие переменные считаются менее значимыми при использовании методов гибридизации ISH, основанных на амплификации генов, и более значимыми для ИГХ, поскольку ДНК более стабильна, чем белок.
Время до фиксации, то есть время между биопсией или резекцией и помещением образца в фиксатор, должно быть как можно короче. Длительность фиксации оказывает большое влияние на результаты и является основным источником изменчивости. Для ИГХ предложен минимальный период фиксации 6-8 ч, руководящие принципы ASCO/CAP рекомендуют, чтобы фиксация не превышала 48 ч.
ИГХ обнаруживает сверхэкспрессию HER2 на уровне белка и зависит от условий проведения процедур тестирования. К ним относятся в дополнение к трем вышеперечисленным: денатурация, нагревание, извлечение антигена, используемая процедура окрашивания и интерпретация окрашивания. Несмотря на то, что существуют методы извлечения антигена, они могут привести к ложноположительным результатам иммуногистохимии.
Для определенного анализа нужно выбирать свой способ фиксации тканей.
Некоторые фиксаторы, химические вещества или тепло, могут помешать анализу FISH. Однако всегда применяется внутренний контроль для того, чтобы отличить отрицательный результат от неинформативного.
А например, иммуногистохимия способна ошибочно классифицировать опухоли на основе фиксированных формалином и внедренных в парафин образцов. А если использовать замороженный образец ткани того же пациента, то можно получить более точный результат. Фиксация формалином и парафиновое встраивание приводят к появлению множества артефактов, которые сбивают результаты анализа с толку. Очень трудно понять, получается действительно достоверный результат или ошибочный. Так утверждают многие специалисты. Результаты теста ИГХ наиболее надежны для свежих или замороженных образцов тканей. ИГХ является ненадежным способом тестирования тканей, которые сохраняются в воске или других химических веществах.
Врач онколог, маммолог, хирург Алексей Галкин. Стаж 18+ лет. Принимает в Университетской клинике. Стоимость приема от 2000 руб.
Золотой стандарт для определения HER2 не установлен. Согласно ASCO/CAPs примерно 20% тестов HER2 могут быть неточными. К ним относятся преаналитические, аналитические и постаналитические переменные.
Причины неточностей анализа статуса HER2/neu
К таким преаналитическим переменным, которые влияют на производительность ИГХ или FISH относятся:
- время, необходимое для фиксации образца ткани;
- продолжительность его нахождения в растворе фиксатора;
- последующая обработка.
Такие переменные считаются менее значимыми при использовании методов гибридизации ISH, основанных на амплификации генов, и более значимыми для ИГХ, поскольку ДНК более стабильна, чем белок.
Время до фиксации, то есть время между биопсией или резекцией и помещением образца в фиксатор, должно быть как можно короче. Длительность фиксации оказывает большое влияние на результаты и является основным источником изменчивости. Для ИГХ предложен минимальный период фиксации 6-8 ч, руководящие принципы ASCO/CAP рекомендуют, чтобы фиксация не превышала 48 ч.
ИГХ обнаруживает сверхэкспрессию HER2 на уровне белка и зависит от условий проведения процедур тестирования. К ним относятся в дополнение к трем вышеперечисленным: денатурация, нагревание, извлечение антигена, используемая процедура окрашивания и интерпретация окрашивания. Несмотря на то, что существуют методы извлечения антигена, они могут привести к ложноположительным результатам иммуногистохимии.
Для определенного анализа нужно выбирать свой способ фиксации тканей.
Некоторые фиксаторы, химические вещества или тепло, могут помешать анализу FISH. Однако всегда применяется внутренний контроль для того, чтобы отличить отрицательный результат от неинформативного.
А например, иммуногистохимия способна ошибочно классифицировать опухоли на основе фиксированных формалином и внедренных в парафин образцов. А если использовать замороженный образец ткани того же пациента, то можно получить более точный результат. Фиксация формалином и парафиновое встраивание приводят к появлению множества артефактов, которые сбивают результаты анализа с толку. Очень трудно понять, получается действительно достоверный результат или ошибочный. Так утверждают многие специалисты. Результаты теста ИГХ наиболее надежны для свежих или замороженных образцов тканей. ИГХ является ненадежным способом тестирования тканей, которые сохраняются в воске или других химических веществах.
Тестирование FISH является предпочтительным способом оценки сохраненных образцов тканей.
- Аналитические факторы – аппаратура и квалификация специалиста также играют роль, и оказывают влияние на достоверность анализа HER2. Чтобы избежать ошибок, необходима регулярная калибровка микроскопов, использование стандартизированных лабораторных процедур, постоянное профессиональное развитие и специализированные программы обучения персонала.
- Постаналитические факторы связаны с интерпретацией результатов анализа, анализом изображений, отчетностью и постоянным обеспечением качества. Интерпретация ИГХ обычно выполняется вручную, включается субъективный фактор и результаты могут варьироваться в зависимости от опыта и бдительности наблюдателя. Например, при анализе ИГХ можно опросить двух патологоанатомов, смотрящих на один и тот же слайд, и один может назвать это 2+ положительное окрашивание, а другой может назвать это 3+ положительное окрашивание.
Оценка с помощью FISH и более новых методов тестирования HER2 CISH, SISH или DDISH, автоматизирована, поэтому является более объективным и количественным, чем с помощью иммуногистохимии. Например, интерпретация теста Fish HER2 – это гораздо более объективный процесс. С помощью анализа FISH патологоанатом подсчитывает фактические копии генов HER2, которые появляются в виде красного “сигнала” в окрашенном в синий цвет ядре раковой клетки, видимом через микроскоп.
Выделяют еще три основных фактора, которые могут привести к неправильному результату:
- Второй анализ на новом срезе фиксированной формалином, залитой парафином ткани, которая поступает из другой части опухоли, может дать другой результат. Хотя такие опухоли встречаются нечасто, но они могут быть HER2-положительными в одних местах и HER2-отрицательными в других.
- Иногда вся хромосома, на которой расположен ген HER2 (наряду с тысячами других генов), амплифицируется в опухолевой ткани. Это называется полисомией хромосомы 17, и ее можно неверно истолковать как амплификацию гена HER2.
- Техническая ошибка в анализе ИГХ (например, если дозатор, который выпускает каплю окрашивающего реагента на предметное стекло, не открывается) может быть обнаружена только путем включения контрольного образца ткани, а он, как известно, набирает 3+ на том же предметном стекле, что и тестируемая ткань. Если такой контрольный образец не используется, отсутствие окрашивания может быть неверно истолковано как отрицательный результат теста. Анализы FISH, в отличие от ИГХ, имеют встроенный контроль для предотвращения ложных отрицательных результатов.
Независимо от того, какой выбран метод определения HER2/neu статуса (иммуногистохимический или с помощью гибридизации FISH, CISH, SISH или DDISH), необходимо, чтобы он был проведен с соблюдением всех требований. Если получен двусмысленный результат, требуется проведение повторного анализа другим методом. Только так можно получить достоверные сведения о статусе HER2. И только таким образом определить возможность проведения таргетной терапии, которая значительно повышает выживаемость пациентов с раком молочной железы.
Продолжение статьи
- Часть 1. Статус HER2 при диагностике опухолей молочных желез. Характеристика. Часть 1.
- Часть 2. Статус HER2 при диагностике опухолей молочных желез. Иммуногистохимическое тестирование. Тесты ISH.
- Часть 3. Ошибки при определении статуса HER2.
Ежегодно в России тысячи лабораторий выполняют миллиарды анализов. Но есть ли гарантия, что результаты ваших лабораторных исследований правдивы?
Ошибки бывают разные: от неправильно определенного уровня гемоглобина до неверной интерпретации цитологического материала. Достоянием гласности становятся только ошибки, повлекшие очень серьезные последствия. Так, например, у 33-летней женщины в результате ошибки лаборанта не было установлено наличие злокачественной опухоли на ранней стадии, хотя она сделала все рекомендованные врачом исследования. Она успокоилась, но, когда опухоль обнаружили, было уже поздно…
Большинство ошибок, к счастью, не влечет сколько-нибудь серьезных последствий. Вы можете и не догадаться об ошибке. Например, если результат анализа показывает низкий уровень гемоглобина, вы просто включаете в рацион богатые железом продукты и железосодержащие пищевые добавки, и повторный анализ показывает, что гемоглобин — в норме. Но даже если результат первого анализа был ошибочным, вы просто съели лишнего «железа».
Где подстерегают ошибки?
Лабораторное исследование состоит из трех частей: преаналитической (от подготовки пациента до момента поступления биоматериала в работу), собственно аналитической и постаналитической (от момента, когда материал покидает прибор, до выдачи результатов пациенту). И на каждом из этих этапов может случиться ошибка.
1. Ошибка может быть заложена уже вначале, при оформлении заказа на исследования. Нa этот этап приходится более половины всех ошибок. Медсестра может неправильно или неразборчиво написать фамилию пациента, перепутать направления на анализы или пробирки.
2. Ошибка может случиться непосредственно во время проведения анализа. В лабораториях, где используют устаревшие методы исследований, вероятность таких ошибок выше. Они не предполагают использования одноразовой лабораторной посуды, многие операции выполняются вручную. Но в оснащенных современными приборами лабораториях вероятность ошибки при проведении исследований практически исключена.
3. Ошибка возможна при интерпретации исследований цитологических и гистологических материалов. В этих случаях применяется исключительно экспертная опенка, то есть врач изучает материал под микроскопом. Есть вероятность, что он «не разглядит» те или иные изменения в клетках или тканях пациента или неверно истолкует их.
4. Виновниками ошибок могут стать сбои в работе приборов.
5. Существует вероятность переноса микроскопических частиц биоматериала из одной пробы в другую, хотя она и очень мала.
Как себя обезопасить?
— Проходите лабораторные исследования только в государственных медицинских учреждениях или коммерческих лабораториях, имеющих лицензию на медицинскую деятельность. Если она не вывешена в рамочке в приемном отделении, попросите показать ее. О высоком качестве работы учреждения свидетельствует и его многолетнее присутствие на рынке медицинских услуг.
— Не стесняйтесь проверять, правильно ли медсестра написала вашу фамилию, инициалы, дату рождения. Проследите, чтобы именно ваши фамилия и имя, идентификационный номер или уникальный штрих-код были нанесены на вашу пробирку.
— Если исследования проводились в рамках диспансеризации или, например, для получения медицинской справки, а результаты показали отклонения от нормы, стоит обратиться к врачу. Он оценит, насколько существенны эти отклонения, и направит на повторные исследования через семь-десять дней. Если отклонения будут зафиксированы вновь, он назначит углубленные исследования.
— Если у вас обнаружены клинические признаки того или иного заболевания, а лабораторные исследования не подтверждают это, то вы можете в индивидуальном порядке вновь провести исследование из того же материала.
— Особый случай — гистологические и цитологические исследования, требующие экспертной оценки. В одних материалы исследуют два врача, в других — один врач, но все сложные и сомнительные случаи отправляются на версификацию в медицинское учреждение, с которым у лаборатории заключен договор.
— Если обнаружен положительный результат на такие социально значимые инфекции, как ВИЧ или гепатит, лаборатория, согласно действующему законодательству, обязана провести подтверждающий тест из того же материала. Пациенту должны сообщать о результатах исследований только после того, как получен окончательно подтвержденный ответ.
Наш эксперт Елена Анатольевна Кондрашева, директор технологического департамента лаборатории INVITRO:
Больше всего ошибок случается при оформлении заказа на исследование. Автоматизация этого процесса может свести такого рода ошибки практически к нулю. На этом этапе сотрудник лаборатории формирует заказ и присваивает ему уникальный штрих-код. Все данные о клиенте тут же в его присутствии вносятся в информационную систему. Штрих-код приклеивается к пробирке и с этой пробиркой клиент идет в процедурный кабинет. В дальнейшем во все приборы пробирка попадает с этим штрих-кодом. Современное оборудование позволяет в 99% случаев использовать «первичную пробирку», т.е. биоматериал, например кровь, не переливается из одной большой пробирки, как было раньше, по нескольким маленьким. Все автоматизировано: пробирка «переезжает» в приборе от одного анализатора к другому, который считывает штрих-код. Таким образом, изначально правильно оформленные пробирки перепутать уже невозможно.