Любой биологический организм со временем стареет, и человек, конечно же, не исключение. С возрастом каждый начинает замечать морщинки на лбу или снижение уровня энергии. Но что именно вызывает угасание человеческого тела? Перевели статью в журнале Business Insider, где представлены девять биологических процессов, совокупность действия которых мы и называем старением.
Чтобы выяснить, что же происходит внутри нашего тела и вызывает возрастные изменения и ухудшения, в 2013 году журнал Cell собрал группу исследователей. Команда, состоящая из ученых, которые изучали различные аспекты старения, провела масштабный анализ всей существующей литературы по старению и написала обзор. Работа «Признаки старения» (так называлась их статья) суммировала все биологическое, что происходит в нашем организме по мере того, как мы стареем. Ученые также разбили эти признаки на девять «процессов» (или причин. — Прим. ред.) старения — посмотрим, что означает каждый из них и как они работают.
В ДНК появляются ошибки
Один из видов повреждений, возникающих вместе со старением, — ошибки, которые начинают появляться в нашей ДНК. Когда ДНК реплицируется, ее код может не всегда копироваться правильно, в итоге некоторые ее части могут быть написаны с ошибками, а целые разделы могут быть случайно вставлены или удалены. Причем эти ошибки не всегда улавливаются механизмами в нашем организме, которые восстанавливают ДНК.
Генетический код — это инструкция для клетки, поэтому по мере накопления ошибок они могут нанести ущерб
Если со временем инструкции становятся неясными или неправильными, это может привести к разрушению клетки и даже к тому, что она станет злокачественной. Ученые обнаружили, что многие клетки в старых тканях имеют много накопленных генетических повреждений. Если исследователи смогут выяснить, как усовершенствовать механизм восстановления ДНК, они смогут улучшить и, возможно, замедлить процесс старения.
Неправильная экспрессия генов
Определенные части ДНК считываются и преобразуются в физические черты. Группа белков в клетках контролирует, какие гены в конечном итоге экспрессируются, — процесс называется эпигенетической модерацией, и именно он гарантирует, что клетки вашей кожи будут отличаться от клеток мозга, даже если они используют один и тот же набор ДНК.
Однако по мере того как мы стареем, белки, связанные с ДНК, становятся более рыхлыми и менее точными, и гены начинают экспрессироваться, когда этого не должно происходить, или замалчиваются по ошибке. В итоге некоторые необходимые белки не производятся, а вредные ненужные — наоборот. Например, если непреднамеренное изменение приводит к подавлению гена, который помогает подавлять опухоли, клетки могут неконтролируемо перерасти в рак. Ученые обнаружили, что устранение этих типов ошибок в экспрессии генов может улучшить некоторые неврологические эффекты старения у мышей, например ухудшение памяти.
Теломеры могут укорачиваться
Теломеры — это защитные колпачки на концах каждой цепи ДНК. Некоторые ученые сравнивают их с пластиковыми кончиками шнурков, которые предохраняют их от износа. Некоторые исследования показывают, что каждый раз, когда клетки делятся, кончики хромосом становятся чуть короче. Когда теломеры теряются, хромосомы становятся нестабильными, и возникают всевозможные проблемы. Наиболее примечательно то, что хромосомы не могут правильно реплицироваться и в конечном итоге становятся фрагментированными или у них появляются лишние части, которых там быть не должно. Такие аномалии обычно убивают клетки или делают их опасными.
Ученые выяснили, как повысить уровень теломеразы — фермента, который может увеличить длину теломер — у мышей, и их исследование показало, что это может продлить продолжительность жизни грызунов. Когда ученые снижали уровень теломеразы у мышей, продолжительность их жизни становилась короче.
Источник: istockphoto.com
Белки становятся менее стабильными и точными в своих ролях
Белки в наших клетках производятся постоянно, и именно они контролируют почти все функции внутри клетки. Они перемещают нужные «материалы», передают сигналы, включают и выключают процессы и обеспечивают структурную поддержку клетки. Но белки необходимо регулярно перерабатывать, потому что со временем они теряют свою эффективность.
С возрастом же наши тела теряют способность устранять старые белки
Когда наши тела не могут перерабатывать неиспользуемые белки, они накапливаются и могут стать токсичными. Накопление белка является одним из основных признаков болезни Альцгеймера: белки, называемые бета-амилоидными агрегатами в головном мозге, приводят к потере нервных клеток.
Клетки не умирают, когда должны
Когда клетки подвергаются стрессу и повреждаются, они иногда перестают делиться и становятся устойчивыми к смерти — превращаются в то, что ученые называют зомби-клетками, которые могут инфицировать другие клетки поблизости и распространять воспаление по всему телу. Такие клетки также называются стареющими клетками.
Со временем и возрастом стареющие клетки накапливаются, и ученые обнаружили, что устранение стареющих клеток у пожилых мышей, по-видимому, обращает вспять некоторые эффекты старения. Точно так же, когда стареющие клетки вводили молодым мышам, они оказывали изнурительное и воспалительное действие и наносили ущерб общему здоровью. В настоящее время разрабатывается несколько препаратов, называемых сенолитиками, которые должны уменьшать количество стареющих клеток у пожилых людей для лечения возрастных заболеваний.
Неисправности в механизме производства энергии
Энергию в клетках, превращая кислород и пищу в энергию, производят митохондрии, и по мере старения организма и его клеток эти миниатюрные электростанции становятся все более неэффективными и нефункциональными. Если же они не функционируют должным образом, они могут производить измененную форму кислорода, которая может вызвать повреждение ДНК и белков.
В исследовании, опубликованном в журнале Nature, ученые смогли обратить вспять появление морщин у мышей, восстановив функцию их митохондрий.
Обмен веществ может нарушиться
Клетки должны адаптироваться к доступному количеству питательных веществ, поэтому, если существует дисбаланс способности клетки воспринимать или обрабатывать питательные вещества, появляются проблемы.
С возрастом клетки становятся менее точными при определении количества глюкозы или жира в организме, поэтому некоторые виды жиров и сахаров не обрабатываются должным образом. То есть в стареющих клетках накапливается чрезмерное их количество не потому, что пожилые люди потребляют много жира, а потому, что клетки не переваривают его должным образом. В итоге это может повлиять на путь передачи инсулина и IGF-1, которые играют большую роль в возникновении диабета.
Именно поэтому возрастной диабет — это довольно распространенное явление: организм пожилых людей больше не может должным образом усваивать все, что они едят.
Источник: unsplash.com
Ткани перестают «чиниться» и обновляться
Почти все ткани в той или иной степени обновляются, но скорость такого обновления с возрастом замедляется, что является одной из причин накопления повреждений. Стволовые клетки — это клетки, которые могут превращаться в разные типы клеток нашего тела. Во многих тканях они действуют как внутренняя система восстановления, восполняя поврежденные или мертвые клетки. С возрастом стволовые клетки истощаются и становятся менее активными, а это означает, что они больше не могут делиться так быстро. Истощение стволовых клеток означает, что ткани, которые должны обновляться, на самом деле больше не делают этого.
Клетки перестают «общаться» друг с другом
Чтобы все в организме работало, клетки должны постоянно «общаться» друг с другом — для этого они посылают сигналы через кровь и иммунную систему. Но по мере того как наши тела стареют, клетки начинают делать это все хуже. Так, некоторые из них становятся менее чувствительными, что может превратить их в стареющие клетки, вызывающие воспаление. При этом само это воспаление еще больше блокирует связь со здоровыми функционирующими клетками.
Когда клетки не могут «общаться», иммунная система не может эффективно избавляться от патогенов и стареющих клеток
Старение также изменяет уровень межклеточной коммуникации в эндокринной и нейроэндокринной системах. То есть сообщения, отправляемые через молекулы гормонов, циркулирующих в этих системах, таких как инсулин, обычно теряются.
Ученые пока не понимают связи между этими девятью согласованными признаками старения, но, по словам *Мануэля Серрано *, одного из авторов статьи, сейчас многие ученые занимаются подобными исследованиями.
Когда ученые в достаточной мере узнают о процессах, лежащих в основе старения, они смогут создавать более эффективные методы лечения, которые могут влиять на то, как мы стареем, и лечить возрастные заболевания.
Ричард Миллер, директор Центра исследований старения Гленна при Мичиганском университете, говорит, что, когда дело доходит до управления старением, «вещи, которые действительно имеют значение, — это основные механизмы контроля в нашем теле, которые регулируют различные виды клеточных событий». По его мнению, настоящая проблема состоит в том, чтобы выяснить, что связывает воедино все процессы, вызывающие разрушение нашего тела.
Просмотров:
595367
Опубликовано:
04.06.2019
/
Обновлено:
09.04.2022
Общие сведения
Старение есть сумма всех механизмов, которые изменяют функции живого существа, препятствуют поддержанию физиологического баланса и в конечном итоге приводят к смерти. Процесс старения это процесс сложный, постепенный, зависящий от многих биологических факторов. Ученые всегда проявляли особый интерес к старению и поиску подходов к изучению этого феномена.
Исследования показали, что старение контролируется генетическими факторами и биологическими процессами, присущими человечеству.
Чтобы замедлить этот естественный процесс и увеличить продолжительности жизни, первым шагом является понимание причин старения: как оно действует на живые организмы, и какие факторы влияют на продолжительность жизни.
Существует 7 основных причин: повреждение генома, эпигенетические факторы, укорочение теломер, развернутая реакция белка, дисфункция митохондрий, клеточное старение и истощение стволовых клеток.
Ошибки репарации ДНК
Геном — это сумма генетической информации человека или вида. Геном является картой для построения всего организма. Генетическая информация, в основном, хранится в ядре клетки в виде молекул ДНК. Участок ДНК, задающий последовательность определённого полипептида, либо функциональной РНК, представляет ген. Геном человека содержит от 25 000 до 30 000 генов.
Но молекулы ДНК не лежат в свободном виде в ядре клетки, они упакованы вместе с белками-гистонами в хромосомы. Хромосомы содержат всю генетическую информацию и реплицируются с каждым клеточным делением.
На протяжении всей жизни клетки делятся множество раз, в результате генетический материал постоянно воспроизводится в живых системах и передается вновь созданным дочерним клеткам. Во время клеточного деления довольно часто наблюдаются генетические ошибки, которые образуются во время репликации ДНК. Они называются ошибками репликации ДНК. Ошибки репликации приводят к нарушению функционирования клетки и могут повлиять на оставшуюся ткань, если клетка не будет устранена в результате запуска апоптоза (гибели клеток) или старения (ухудшения функций клетки).
В организме также существует система, которая восстанавливает молекулу ДНК, модифицированную во время репликации. Система использует белки и ферменты. PARP1 — участвует в репарации ДНК и сиртуинов, а также в регуляции экпрессии генов, ремоделировании хроматина и функционировании митохондрий. NAD+ является косубстратом PARP. С возрастом происходит увеличение экспрессии белков PARP, что говорит о частых ошибках репликации и необходимости их устранения. В ответ на повреждения ДНК из-за работы PARP в клетке также очень быстро истощаются запасы NAD+, что приводит к клеточной гибели.
Активация фермента PARP может индуцировать сверхэкспрессию белка P53. Белок Р53 представляет другую систему контроля жизненного цикла клетки. Р53 отвечает за элиминацию канцерогенных клеток и позволяет продлить жизнь органов, предотвращая развитие раковых клеток. Однако, чем больше белка активируется, тем больше он ускоряет процесс старения, приводя к усиленному разрушению клеток и потери гомогенности тканей.
Механизм укорочения теломерных повторов
Способность диплоидных клеток к пролиферации ограничена. Этот процесс регулируется теломерами. Теломеры оказывают защитное действие на ДНК. Теломеры являются той частью хромосомы, которая не содержит генетической информации, и разрушаются на протяжении всей жизни при каждой репликации до тех пор пока полностью не исчезнут. Поскольку ДНК больше не защищена, при репликации важная информация «разжевывается», что приводит к апоптозу клетки или созданию раковой клетки. Фермент теломераза обеспечивает полную репликацию теломер. Он обнаружен только в стволовых, эмбриональных и раковых клетках. Присутствие этого фермента в раковых клетках объясняет, почему они бессмертны: они могут делиться бесконечно, не останавливаясь на своих «биологических часах». Работа этого фермента представляет большой научный интерес, однако, его активация может быть связана с виндукцией злокачественной трансформации.
Сокращение теломер можно сравнить с биологическими часами, которые активируют старение клеток, как только время истекает. Этот механизм ограничивает продолжительность жизни всех клеток, поэтому является центральным.
Эпигенетические механизмы и старение
Эпигенетика занимается изучением механизмов, управляющих экспрессией генома. Экспрессия генов может варьировать в зависимости от факторов окружающей среды. Органы демонстрируют эту изменчивость: каждая клетка имеет сходную генетическую информацию, но разные функции, что показывает разницу в экспрессии генов в зависимости от окружающей среды.
Существует несколько эпигенетических механизмов регуляции активности генов:
- Реакции метилирования.
Метилирование — это эпигенетическая модификация генома посредством добавления или удаления метильной группы. Реакции метилирования могут активировать, ингибировать экспрессию генов, или повысить вероятность мутации. Процесс метилирования оказывает влияние на рецепторы эстрогенов, опухолевые супрессоры и другие важные гены. Эпигенетические модификации, связанные с метилированием, растут с возрастом и могут привести к серьезным проблемам со здоровьем.
- Ремоделирование хроматина.
В ядре ДНК принимает форму хроматина, что позволяет компактизовать генетический материал. С возрастом ремоделирование хроматина уменьшается, стабильность хромосом снижается, что сопровождается преждевременным старением.
- Модификация гистонов.
Гистоны — это белки, вокруг которых обернута ДНК. Они составляют большую часть хромосомы. Любая модификация компонентов гистонов может изменить экспрессию генов. Например, некоторые гормоны ответственны за добавление или удаление компонентов гистонов (сиртуинов, NF-kB) и влияют на стабильность генома. Модификация гистонов влияет на продолжительность жизни посредством модификаций экспрессии некоторых генов.
Нарушение конформации белков, как причина старения
Белки представлены полипептидной цепью, состоящей из последовательности аминокислот. Работают белки благодаря своей конформационной структуре: вторичной, третичной, четвертичной. Складывание белка представляет физический процесс-фолдинг, посредством которого белок становится функционально активным.
Исследования показали, что нарушение процесса фолдинга белка составляет патофизиологическую основу многих возрастных заболеваний различной этиологии, в том числе болезни Альцгеймера, болезнь Паркинсона и прочих.
Последствия нарушения конформационных структур связаны с накоплением агрегатов белков неправильной конформации.
Митохондриальная дисфункция и возраст
Митохондрии — это клеточные органеллы, ответственные за поддержание клеточного дыхания и синтез АТФ — основного источника энергии. Митохондрии обладают собственной ДНК, называемой мтДНК.
Дисфункция митохондрии является основной причиной старения из-за жизненно важной роли митохондрий в клетках. Возрастная дисфункция наблюдается с возрастом, может привести к гибели клетки. Ее причиной служит окислительный стресс, нарушение клеточно-митохондриальной связи.
Клеточное старение
Клеточное старение происходит, когда возраст клетки увеличивается и ее функция уменьшается. Клетка прекращает делиться и меняет свою активность. Стареющие клетки можно увидеть на всех этапах жизни. С возрастом их число увеличивается в некоторых тканях, вызывая их гетерогенность.
Механизм клеточного старения полезен в молодости. Он защищает организм от пролиферации раковых клеток, но требует эффективной работы иммунной системы для устранения стареющих клеток. При старении эффективность иммунной системы снижается, обновления стволовых клеток происходит реже.
Стволовые клетки
Стволовые клетки — это недифференцированные клетки, которые не принадлежат к какому-либо конкретному органу и поэтому могут генерировать специализированные клетки посредством «клеточной дифференцировки».
Стволовые клетки позволяют обновлять клетки в органе, они хранятся в организме и используются при необходимости.
Некоторые клетки стареют и умирают регулярно и требуют замены. Срок жизни эритроцита в среднем 120 дней. Другие органы могут расти и требовать больше ткани (например, матка во время беременности). Некоторые органы не имеют стволовых клеток и поэтому не могут быть обновлены при повреждении, например, сердце, поджелудочная железа.
При старении ткани также не восстанавливаются из-за замедления деления клеток и отсутствия замены стволовых клеток. Это объясняется избыточной экспрессией белков, блокирующих клеточный цикл, или накоплением повреждений ДНК на стволовых клетках.
Истощение стволовых клеток является одной из основных причин старения, поскольку препятствует обновлению клеток и является причиной старения органов. Понимание работы стволовых клеток будет жизненно важным для регенеративной медицины в будущем.
Заключение
Вышеуказанные причины потенциально ответственны за изменение функций организма. Некоторые из них лежат в основе полезных механизмов, которые становятся вредными с возрастом, как в случае с клеточным старением и системой репарации ДНК. Механизмы предотвращают развитие рака, но по мере того, как их активность становится слишком высокой, происходит сбой, дегенерация тела ускоряется.
Другими причинами являются простые механизмы, которые медленно развиваются во времени (митохондриальная дисфункция, укорочение теломер). Необходимо понимать их, если мы когда-нибудь захотим поработать над этим, чтобы потенциально замедлить старение, и увеличить продолжительность жизни человека.
«Старение – это ошибка»
Гипотеза
«старения по ошибке» была выдвинута в
1954 г. американским физиком М. Сциллардом.
Исследуя эффекты воздействия радиации
на живые организмы, он показал, что
действие ионизирующего излучения
существенно сокращает срок жизни людей
и животных. Под воздействием радиации
происходят многочисленные мутации в
молекуле ДНК и инициируются некоторые
симптомы старения, такие как седина или
раковые опухоли. Из своих наблюдений
Сцилард сделал вывод, что мутации
являются непосредственной причиной
старения живых организмов. Однако он
не объяснил факта старения людей и
животных, не подвергавшихся облучению.Его
последователь Л. Оргель считал, что
мутации в генетическом аппарате клетки
могут быть либо спонтанными, либо
возникать в ответ на воздействие
агрессивных факторов – ионизирующей
радиации, ультрафиолета, воздействия
вирусов и токсических (мутагенных)
веществ и т. д. С течением времени система
репарации ДНК изнашивается, в результате
чего происходит старение организма.
Теория апоптоза (самоубийства клеток)
Академик
В. П. Скулачев называет свою теорию
теорией клеточного апоптоза. Апоптоз
(греч. «листопад») – процесс
запрограммированной гибели клетки. Как
деревья избавляются от частей, чтобы
сохранить целое, так и каждая отдельная
клетка, пройдя свой жизненный цикл,
должна отмереть и ее место должна занять
новая. Если клетка заразится вирусом,
или в ней произойдет мутация, ведущая
к озлокачествлению, или просто истечет
срок ее существования, то, чтобы не
подвергать опасности весь организм,
она должна умереть. В отличие от некроза
– насильственной гибели клеток из-за
травмы, ожога, отравления, недостатка
кислорода в результате закупоривания
кровеносных сосудов и т. д., при апоптозе
клетка аккуратно саморазбирается на
части, и соседние клетки используют ее
фрагменты в качестве строительного
материала.
Самоликвидации
подвергаются и митохондрии – изучив
этот процесс, Скулачев назвал его
митоптозом. Митоптоз происходит, если
в митохондриях образуется слишком много
свободных радикалов. Когда количество
погибших митохондрий слишком велико,
продукты их распада отравляют клетку
и приводят к ее апоптозу. Старение, с
точки зрения Скулачева, – результат
того, что в организме гибнет больше
клеток, чем рождается, а отмирающие
функциональные клетки заменяются
соединительной тканью. Суть его работы
– поиск методов противодействия
разрушению клеточных структур свободными
радикалами. По мнению ученого, старость
– это болезнь, которую можно и нужно
лечить, программу старения организма
можно вывести из строя и тем самым
выключить механизм, сокращающий нашу
жизнь.По мнению Скулачева, главная из
активных форм кислорода, приводящих к
гибели митохондрий и клеток – перекись
водорода. В настоящее время под его
руководством проходит испытания препарат
SKQ, предназначенный для предотвращения
признаков старения.
БИЛЕТ
№ 35
1.Предмет,
задачи и методы генетики. Наследственность
и изменчивость. Понятие о генетическом
материале. Роль ядра и цитоплазмы в
наследственности и изменчивости.
Генетика—-
наука о наследственности и изменчивости
живых организмов и методах управления
ими. В ее основу легли закономерности
наследственности, установленные
выдающимся чешским ученым Грегором
Менделем (1822—1884) при скрещивании
различных сортов гороха.
Наследственность
— это неотъемлемое свойство всех живых
существ сохранять и передавать в ряду
поколений характерные для вида или
популяции особенности строения,
функционирования и развития.
Наследственность обеспечивает постоянство
и многообразие форм жизни и лежит в
основе передачи наследственных задатков,
ответственных за формирование признаков
и свойств организма. Благодаря
наследственности некоторые виды
(например, кистеперая рыба латимерия,
жившая в девонском периоде) оставались
почти неизменными на протяжении сотен
миллионов лет, воспроизводя за это время
огромное количество поколений.
В
то же время в природе существуют различия
между особями как разных видов, так и
одного и того же вида, сорта, породы и
т. д. Это свидетельствует о том, что
наследственность неразрывно связана
с изменчивостью.
Изменчивость
— способность организмов в процессе
онтогенеза приобретать новые признаки
и терять старые. Изменчивость выражается
в том, что в любом поколении отдельные
особи
чем-то отличаются и друг от друга, и от
своих родителей. Причиной этого является
то, что признаки и свойства любого
организма есть результат взаимодействия
двух факторов: наследственной информации,
полученной от родителей, и конкретных
условий внешней среды, в которых шло
индивидуальное развитие каждой особи.
Поскольку условия среды никогда не
бывают одинаковыми даже для особей
одного вида или сорта (породы), становится
понятным, почему организмы, имеющие
одинаковые генотипы, часто заметно
отличаются друг от друга по фенотипу,
т. е. по внешним признакам.
Таким
образом, наследственность, будучи
консервативной, обеспечивает сохранение
признаков и свойств организмов на
протяжении многих поколений, а изменчивость
обусловливает формирование новых
признаков в результате изменения
генетической информации или условий
внешней среды.
Задачи
генетики вытекают из установленных
общих закономерностей наследственности
и изменчивости. К этим задачам относятся
исследования: 1) механизмов хранения и
передачи генетической информации от
родительских форм к дочерним; 2) механизма
реализации этой информации в виде
признаков и свойств организмов в процессе
их индивидуального развития под контролем
генов и влиянием условий внешней среды;
3) типов, причин и механизмов изменчивости
всех живых существ; 4) взаимосвязи
процессов наследственности, изменчивости
и отбора как движущих факторов эволюции
органического мира.
Генетика
является также основой для решения ряда
важнейших практических задач. К ним
относятся: 1) выбор наиболее эффективных
типов гибридизации и способов отбора;
2) управление развитием наследственных
признаков с целью получения наиболее
значимых для человека результатов; 3)
искусственное получение наследственно
измененных форм живых организмов; 4)
разработка мероприятий по защите живой
природы от вредных мутагенных воздействий
различных факторов внешней среды и
методов борьбы с наследственными
болезнями человека, вредителями
сельскохозяйственных растений и
животных; 5) разработка методов генетической
инженерии с целью получения высокоэффективных
продуцентов биологически активных
соединений, а также для создания
принципиально новых технологий в
селекции микроорганизмов, растений и
животных.
При
изучении наследственности и изменчивости
на разных уровнях организации живой
материи (молекулярный, клеточный,
организменный,
популяционный) в генетике используют
разнообразные методы современной
биологии: гибридологический,
цитогенетический, биохимический,
генеалогический, близнецовый, мутационный
и др. Однако среди множества методов
изучения закономерностей наследственности
центральное место принадлежит
гибридологическому методу. Суть его
заключается в гибридизации (скрещивании)
организмов, отличающихся друг от друга
по одному или нескольким признакам, с
последующим анализом потомства. Этот
метод позволяет анализировать
закономерности наследования и изменчивости
отдельных признаков и свойств организма
при половом размножении, а также
изменчивость генов и их комбинирование.
Наследственность
и изменчивость являются одними из
определяющих факторов эволюции
органического мира.
Наследственность
— это свойство живых организмов сохранять
и передавать потомству особенности
своего строения и развития. Благодаря
наследственности из поколения в поколение
сохраняются признаки вида, сорта, породы,
штамма. Связь между поколениями
осуществляется при размножении через
гаплоидные или диплоидные клетки (см.
разделы «Ботаника» и «Зоология»). Из
органоидов клетки ведущая роль в
наследственности принадлежит хромосомам,
способным к самоудвоению и формированию
с помощью генов всего комплекса
характерных для вида признаков (см.
главу «Клетка»). В клетках каждого
организма содержатся десятки тысяч
генов. Вся их совокупность, характерная
для особи вида, называется генотипом.
Изменчивость
противоположна наследственности, но
неразрывно с ней связана. Она выражается
в способности организмов изменяться.
Благодаря изменчивости отдельных особей
популяция оказывается разнородной.
Дарвин различал два основных типа
изменчивости.
Ненаследственная
изменчивость (см. о модификациях в главе
«Основы генетики и селекции») возникает
в процессе индивидуального развития
организмов под влиянием конкретных
условий среды, вызывающих у всех особей
одного вида сходные изменения, поэтому
Дарвин эту изменчивость назвал
определенной. Однако степень таких
изменений у отдельных индивидуумов
может быть различной. Например, у травяных
лягушек низкие температуры вызывают
темную окраску, но интенсивность ее у
разных особей различна. Дарвин считал
модификации не существенными для
эволюции, так как они, как правило, не
наследуются.
Наследственная
изменчивость (см. о мутациях в главе
«Основы генетики и селекции») связана
с изменением генотипа особи, поэтому
возникшие изменения наследуются. В
природе мутации появляются у единичных
особей под влиянием случайных внешних
и внутренних факторов. Характер их
предсказать трудно, поэтому Дарвин эту
изменчивость. назвал неопределенной.
Мутации бывают незначительными и
существенными и затрагивают различные
признаки и свойства. Например, у дрозофилы
под влиянием рентгеновских лучей
изменяются крылья, щетинки, окраска
глаз и тела, плодовитость и т. д. Мутации
могут быть полезными, вредными и
безразличными для организма.
К
наследственной изменчивости относится
комбинативная изменчивость. Она возникает
при свободных скрещиваниях в популяциях
или при искусственной гибридизации. В
результате рождаются особи с новыми
сочетаниями признаков и свойств,
отсутствовавшими у родителей (см. о
дигибридном скрещивании, новообразованиях
при скрещиваниях, перекресте хромосом
в главе «Основы генетики и селекции»).
Соотносительная изменчивость также
наследственна; она выражается в том,
что изменение одного органа вызывает
зависимые изменения других (см. в главе
«Основы генетики и селекции» множественное
действие гена). Например, у гороха с
пурпурными цветками всегда с таким же
оттенком черешки и жилки листьев. У
болотных птиц длинные конечности и шея
всегда сопровождаются длинными клювом
и языком. Наследственную изменчивость
Дарвин считал особенно важной для
эволюции, так как она служит материалом
для естественного и искусственного
отборов при образовании новых популяций,
видов, сортов, пород и штаммов.
ГЕНЕТИЧЕСКИЙ
МАТЕРИАЛ любой материал растительного,
животного, микробного или иного
происхождения, содержащий функциональные
единицы наследственности ( Конвенция
о биологическом разнообразии. )
Ядро
— основной компонент который несет
информацию. Оно может находиться двух
состояниях: покоя — интерфазы_ж_Дбления
— митоза или мейоза. Интерфазное ядро
представляет собой круглое «образование»
с многочисленными глыбками белкового
вещества, названного хроматином. Выделяет
два типа хроматина: гетерохроматин и
эухроматин. Первый из Waxможно наблюдать
в интерфазном ядре под световым, второй
— только под электронным микроскопом.
Гетерохроматин и ухроматин выполняют
разные функции в генетическом биосинтеза
белков.
Детальнде
изучение ядра под эектрнным микроскопом
показало, что хроматин состоит из очень
тонких нитей, получив-ЧВТТ звание
хромосом. Именно в них заложена основная
часть — Шнетической информации индивидуума.
Тельца,
называемые ядрышками. Количество их в
зависимости от типа клеток неодинаково.
По современным данным, на ядрышках
осуществляется синтез рибосомной
рибонуклеиновой кислоты (рРНК), а также
ядерных белков (гистонов). Участки, или
районы, хромосом, где происходит синтез
рРНК, называют организаторами ядрышка.
Например, у свиней организаторы ядрышка
найдены на~3=й и 10-й хромосомах. Учеными
обнаружены изменчивость в ядрыш-кообразующих
районах хромосом свиней и связь этого
явления с отдельными болезнями, в
частности с прогрессирующей атаксией
и синдромом нарушения координации
движений.
2.
Биотические факторы. Цепи питания.
Правило экологической пирамиды. Концепция
биогеоценоза. Экологическая сукцессия
и климакс.
Биотические
факторы окружающей среды (Биотические
факторы; Биотические экологические
факторы; Biotic factors; Biological factors; от греч.
Biotikos — жизненный) — факторы живой среды,
влияющие на жизнедеятельность организмов.
Беклемишев
В.Н. разделил биотические факторы на 4
группы:
топические
— по изменению среды (разрывание почвы)
трофические
— пищевые отношения (продуценты,
консументы, редуценты)
фабрические
— по жилищу (паразитические черви
используют организм как среду обитания)
форические
— по переносу (рак отшельник переносит
актинию)
Действие
биотических факторов выражается в форме
взаимовлияний одних организмов на
жизнедеятельность других организмов
и всех вместе на среду обитания. Различают
прямые и косвенные взаимоотношения
между организмами.
Внутривидовые
взаимодействия между особями одного и
того же вида складываются из группового
и массового эффектов и внутривидовой
конкуренции.
Межвидовые
взаимоотношения значительно более
разнообразны. Возможные типы комбинации
отражают различные виды взаимоотношений:
нейтрализм
— взаимоотношения между организмами
не приносят друг другу ни вреда, ни
пользы
синойкия
(квартирантство) — сожительство, при
котором особь одного вида использует
особь другого вида только как жилище,
не принося своему «живому дому» ни
пользы, ни вреда. Например, пресноводная
рыбка горчак откладывает икринки в
мантийную полость двухстворчатых
моллюсков. Развивающиеся икринки надежно
защищены раковиной моллюска, но они
безразличны для хозяина и не питаются
за его счет.
конкуренция
— антагонистические отношения между
организмами (видами), связанные борьбой
за пищу, самку, место обитания и другие
ресурсы
мутуализм
(взаимовыгодный симбиоз) — совместное
сожительство организмов разных видов,
приносящее взаимную пользу. Например,
лишайники являются симбиотическими
организмами, тело которых построено из
водорослей и грибов. Нити гриба снабжают
клетки водоросли водой и минеральными
веществами, а клетки водорослей
осуществляют фотосинтез и, следовательно,
снабжают гифы грибов органическими
веществами.
протокооперация
(кооперация) — это полезные взаимоотношения
организмов, когда они могут существовать
друг без друга, но вместе им лучше.
Например, рак-отшельник и актиния, акулы
и рыбы-прилипалы.
комменсализм
— совместное сожительство организмов
разных видов, при котором один организм
использует другой как жилище и источник
питания, но не причиняет вреда партнеру.
Например, некоторые морские полипы,
поселяясь на крупных рыбах, в качестве
пищи используют их испражнения. В
желудочно-кишечном тракте человека
находится большое количество бактерий
и простейших, питающихся остатками пищи
и не причиняющих вреда хозяину.
аменсализм
— это взаимоотношения между организмами,
при которых один несет ущерб, а другому
они безразличны. Например, гриб пеницилл
выделяет антибиотик, убивающий бактерий,
но вторые на гриб никак не влияют.
паразитизм
— это форма антагонистического
сожительства организмов, относящихся
к разным видам, при котором один организм
(паразит), поселяясь на теле или в теле
другого организма (хозяина), питается
за его счет и причиняет вред. Болезнетворное
действие паразитов слагается из
механического повреждения тканей
хозяина, отравления его продуктами
обмена, питания за его счет. Паразитами
являются все вирусы, многие бактерии,
грибы, простейшие, некоторые черви и
членистоногие. В отличие от хищника
паразит использует свою жертву длительно
и далеко не всегда приводит ее к смерти.
Нередко вместе со смертью хозяина
погибает и паразит. Связь паразита с
внешней средой осуществляется
опосредованно через организм хозяина.
хищничество.
Пищева́я
(трофи́ческая) цепь — ряды видов растений,
животных, грибов и микроорганизмов,
которые связаны друг с другом отношениями:
пища — потребитель.
Пищевая
цепь представляет собой связную линейную
структуру из звеньев, каждое из которых
связано с соседними звеньями отношениями
«пища — потребитель». В качестве звеньев
цепи выступают группы организмов,
например, конкретные биологические
виды. Связь между двумя звеньями
устанавливается, если одна группа
организмов выступает в роли пищи для
другой группы. Первое звено цепи не
имеет предшественника, то есть организмы
из этой группы в качестве пищи не
использует другие организмы, являясь
продуцентами. Чаще всего на этом месте
находятся растения, грибы, водоросли.
Организмы последнего звена в цепи не
выступают в роли пищи для других
организмов.
Каждый
организм обладает некоторым запасом
энергии, то есть можно говорить о том,
что у каждого звена цепи есть своя
потенциальная энергия. В процессе
питания потенциальная энергия пищи
переходит к её потребителю. При переносе
потенциальной энергии от звена к звену
до 80-90 % теряется в виде теплоты. Данный
факт ограничивает длину цепи питания,
которая в природе обычно не превышает
4-5 звеньев. Чем длиннее трофическая
цепь, тем меньше продукция её последнего
звена по отношению к продукции начального.
Организмы
последующего звена поедают организмы
предыдущего звена, и таким образом
осуществляется цепной перенос энергии
и вещества, лежащий в основе круговорота
веществ в природе. При каждом переносе
от звена к звену теряется большая часть
(до 80—90 %) потенциальной энергии,
рассеивающейся в виде тепла. По этой
причине число звеньев (видов) в цепи
питания ограничено и не превышает обычно
4—5.
Антагонистические
взаимоотношения паразитов и хищников
со своими жертвами поддерживают
численность популяции одних и других
на определенном относительно постоянном
уровне, что имеет большое значение в
выживании видов.
Правило
экологической пирамиды
Количество
растительного вещества, служащего
основой цепи питания, примерно в 10 раз
больше, чем масса растительноядных
животных, и каждый последующий пищевой
уровень также имеет массу, в 10 раз
меньшую.
Биогеоценоз
— это динамическое и устойчивое
сообщество растений,
животных
и микроорганизмов, находящееся в
постоянном взаимодействии и
непосредственном
контакте с компонентами атмосферы,
гидросферы и литосферы.
Биогеоценоз
состоит из биотической (биоценоз)
и
абиотической (экотоп) частей,
которые
связаны непрерывным обменом веществом,
и представляет собой
энергетически
и вещественно открытую систему (рис.
16.2). В него поступают энергия Солнца,
минеральные вещества
почвы,
газы атмосферы, вода. Из него выделяются
теплота, кислород, углекислый
газ,
биогенные вещества, переносимые водой,
перегной.
Биогеоценоз
содержит следующие обязательные
компоненты
(рис. 16.3): 1) абиотические
неорганические
и органические вещества среды; 2)
автотрофные
организмы — продуценты
биотических
органических веществ; 3)
гетеротрофные
организмы (консументы) —
потребители
готовых органических веществ первого
(растительноядные животные) и
следующих
(плотоядные животные) порядков; 4)
детритоядные
организмы —
редуценты-разрушители,
разлагающие органическое вещество.
Как
через любую диссипативную (т.е. рассеивающую
энергию)
систему, через биогеоценоз протекает
регулируемый поток энергии. Эта
энергия
затрачивается на обеспечение постоянного
круговорота веществ,
поддержание
целостности системы и обеспечение ее
эволюции. Энергия проходит
через
серию трофических уровней, являющихся
звеньями цепей питания.
Рис.
16.2. Биогеоценоз — открытая
экологическая
система
Первичным
источником энергии служит солнечное
излучение,
энергия которого составляет 4,6 •
1026
Дж/с (1,1 • 1026
кал/с).
1/2000000 этого количества
энергии
достигает поверхности Земли, при этом
1,0—2,0%
ассимилируются
растениями, 30—70%
поглощенной
энергии используется ими для обеспечения
собственной
жизнедеятельности
и синтеза органических веществ.
Энергия,
накопленная в растительной биомассе,
составляет
чистую первичную продукцию
биогеоценоза.
Фитобиомасса используется в качестве
источника энергии и
материала
для создания биомассы потребителей
первого порядка — растительноядных
животных и далее по пищевой
цепи.
Количество энергии, расходуемой на
поддержание собственной жизнедеятельности,
в
цепи трофических уровней растет, а
продуктивность падает. Обычно
продуктивность
последующего трофического уровня
составляет не более 5—20% предыдущего.
Это находит отражение в
соотношении
на планете биомасс растительного и
животного происхождения.
Так,
суммарная биомасса организмов, обитающих
на
суше,
составляет примерно 3 • 1012
т.
Лишь 1—3% этого количества — зообиомасса.
Масса животного вещества,
приходящегося
на людей, составляет около 0,0002%
от
суммарной массы живого вещества планеты.
Объем энергии, необходимый для
обеспечения
жизнедеятельности организма, растет с
повышением уровня
морфофунк-циональной
организации. Соответственно количество
биомассы,
создаваемой
на более высоких трофических уровнях,
снижается. Например, в разных
биогеоценозах
95—99,5% зообиомаесы
приходится
на беспозвоночных животных.
Рис.
16.3. Живые организмы — компоненты
биогеоценоза
Прогрессивное
снижение ассимилированной энергии в
ряду
трофических уровней находит отражение
в структуре экологических пирамид.
Продукция
живого вещества растительноядными
животными
составляет в данном случае 12,5%,
а
человеком — 0,6% продукции растений.
Снижение
количества доступной энергии на каждом
последующем трофическом уровне
сопровождается
уменьшением биомассы и численности
особей. Таким образом,
пирамиды
биомассы и численности организмов для
данного биогеоценоза повторяют в
общих
чертах конфигурацию пирамиды
продуктивности.
Размеры
биогеоценозов, выделяемых экологами,
различны.
Совокупности определенных биогеоценозов
образуют главные природные экосистемы,
имеющие глобальное значение в обмене
энергии
и вещества на планете. К ним относят: 1)
тропические
леса; 2) леса умеренной
климатической
зоны; 3) пастбищные земли
(степь,
саванна, тундра, травянистые ландшафты);
4)
пустыни и полупустыни; 5)
озера,
болота, реки, дельты; 6) горы; 7) острова;

моря.
Главным
компонентом биогеоценоза, от состояния
которого
зависят его существование и изменения
во времени, служит биоценоз. Биоценозы
отличаются по
видовому
составу, и важнейшей их характеристикой
является постоянное прямое или
опосредованное
взаимодействие популяций организмов
друг с другом. Влияние любой
популяции
распространяется до экологически
отдаленных элементов биоценоза через
взаимодействие
с конкурентами, хищниками, жертвами.
Так, насекомоядные птицы не
оказывают
прямого действия на растения, но, снижая
численность насекомых,
питающихся
листьями или опыляющих растения, они
тем самым воздействуют на
воспроизведение
фитобиомассы. Последнее существенно
для состояния популяций и продуктивности
растительноядных
животных, хищников, паразитов. Экологические
влияния отдельной
популяции
распространяются в биоценозе во всех
направлениях, но по мере
прохождения
последовательных звеньев в цепи
взаимодействия интенсивность
влияния
ослабевает.
Показателями
структуры и функционирования биоценозов
служат
их видовой состав, число трофических
уровней, первичная продуктивность,
интенсивность
потока энергии и круговоротов веществ.
Структура биоценозов
складывается
в процессе эволюции, причем каждый вид
организмов эволюционирует
таким
образом, чтобы занять в биоценозе
определенное место. Совместное
историческое
развитие многих видов на одной территории
способствует их
специализации
к использованию лишь части наличных
пищевых ресурсов и
ограниченному
местообитанию. В результате достигается
состояние
взаимоприспособленности
видов друг к другу, или коадаптации,
которая служит обязательным условием
стабильности
биоценоза.
В
качестве примера рассмотрим ситуацию,
возникшую в
искусственном
оз. Гатун, которое образовалось в начале
XX столетия в зоне Панамского канала. В
течение нескольких
десятилетий
биоценоз озера отличался стабильностью
благодаря коадаптации
организмов
основной пищевой цепи: фитопланктон —
зоопланктон
— планктоноядные рыбы.
Последние,
поедая зоопланктон, снижали его
численность, что способствовало
поддержанию
количества фитопланктона на достаточно
высоком уровне. В 1967 г. случайно в озеро
была интродуцирована
хищная,
прожорливая рыба туканаре. Она быстро
сократила численность
планктоноядных
рыб, что привело к размножению зоопланктона
и сокращению
количества
фитопланктона. Одновременно снизилась
численность обитающих на озере
крачек
и зимородков, питающихся рыбой, и
повысилась численность комаров,
личинки
которых прежде поедались рыбой.
Таким
образом, появление нового вида вызвало
серьезные
нарушения в экономике биоценоза озера
и временно дестабилизировало
его
структуру. В дальнейшем, по мере развития
коадаптации, при измененном
видовом
составе стабильность биоценоза может
восстановиться. Состояние
коадаптации
достигается даже между видами-антагонистами:
хищником и жертвой,
хозяином
и паразитом.
Наиболее
устойчивыми являются биогеоценозы,
характеризующиеся:
1) большим видовым
разнообразием,
2) наличием
неспециализированных
видов, 3) слабой
степенью
отграниченности от соседних экологических
систем и 4) большой биомассой. Действительно,
разнообразие
видового состава биоценозов обеспечивает
реальное существование не
столько
цепей, сколько сетей питания, поскольку
на каждом трофическом уровне
находятся
организмы разных видов, способные
заместить друг друга в выполнении
функций
биотического круговорота веществ при
изменении экологической ситуации
(рис.
16.4).
Неспециализированные
виды, способные обитать в
меняющихся
условиях и использовать разные источники
питания, объединяют разные
трофические
уровни экологической пирамиды, упрочивая
тем самым ее структуру.
Обмен
видами между соседними биоценозами
может обеспечить восстановление даже
существенно
нарушенного экологического равновесия.
Большое количество вещества,
накопленного
в виде биомассы, обладает свойствами
буферности, обеспечивая
систему
веществом и энергией при длительном
действии неблагоприятных
экологических
факторов, например, во время полярной
ночи в высоких широтах или
при
длительных сезонных наводнениях в
странах с муссонным климатом.
Рис.
16.4. Пищевая сеть в биогеоценозе смешанного
леса
Тесные
коадаптации популяций разных видов,
входящих
в
состав биоценоза, проявляются, как и
любые другие эволюционные события; на
фенотипическом
уровне, но по существу они —
результат
микро- и макроэволюционных процессов,
затрагивающих в первую очередь
их
генофонды. Поэтому экологический
гомеостаз базируется на коадаптациях
популяционных
генофондов и проявляется как выражение
свойства наследственности на
биогеоценотическом уровне.
Приобретение
экологической системой новых видов или
их утрата, изменение
скорости
и объема круговорота веществ, связанное
с изменениями генофондов
популяций
биоценоза, а также приспособление его
в целом как системы к
меняющимся
экологическим факторам есть проявление
свойства изменчивости. Другие
характеристики живых систем — обмен
веществ, выступающий в биогеоценозе в
виде
биогенного круговорота, и самовоспроизведение,
в результате которого на
базе
исходного биогеоценоза возможно
возникновение дочерних экосистем, —
также проявляются на этом уровне
организации
жизни.
Благодаря этому в биогеоценозах
реализуется и такое фундаментальное
свойство
живого, как способность эволюционировать.
3.
Основные формы биотических связей в
антропобиоценозах. Паразитизм как
биологический феномен. Карликовый
цепень. Биологические основы аутоинвазии.
Паразити́зм
(от др.-греч. παράσιτος —
«нахлебник») — один из видов сосуществования
организмов. Это явление, при котором
два и более организма, не связанные
между собой филогенетически, генетически
разнородны, сосуществуют в течение
продолжительного периода времени, при
этом они находятся в антагонистических
отношениях. Паразит использует хозяина
как источник питания, среду обитания.
Таким образом, комар является непостоянным
паразитом, хотя в этом случае взаимодействие
между организмами носит эпизодический
характер, самки комаров потребляют
кровь хозяина. В сфере медицинской
паразитологии термин «паразит» означает
эукариотический патогенный организм.
Простейшие и многоклеточные возбудители
инфекции классифицируются как паразиты.
Грибы не обсуждаются в учебниках
медицинской паразитологии, хотя они
являются эукариотами. Среди архей (они
не являются эукариотами) по состоянию
на 2003 год был известен лишь один
паразитический организм — Nanoarchaeum
equitansФормы паразитизма и
связанные с этим взаимные адаптации
паразитов и их хозяев чрезвычайно
многообразны. Различают эктопаразитизм,
при котором паразит обитает на хозяине
и связан с его покровами (клещи, блохи,
вши и др.), и эндопаразитизм, при котором
паразит живет в теле хозяина (паразитические
черви, простейшие и др.) По степени
тесноты связей паразита и хозяина
выделяют две формы паразитизма: облигатный
и факультативный. В первом случае вид
ведет только паразитический образ жизни
и не выживает без связи с хозяином
(паразитические черви, вши). Факультативные
паразиты, как правило, ведут свободный
образ жизни и лишь при особых условиях
переходят к паразитическому состоянию.
По продолжительности связей с хозяином
существуют постоянные и временные
паразиты; на сегодняшний день известен
только один паразит, который функционально
замещает собой орган хозяина — Cymothoa
exigua. Существуют также
различные формы «социального паразитизма»:
клептопаразитизм (то есть присвоение
чужой пищи), в том числе его особая форма
— т. н. яичный паразитизм, наблюдаемый
у некоторых видов рыб, птиц и насекомых,
когда для высиживания яиц и воспитания
новорожденных один организм подкидывает
свои яйца в гнездо другого (характерный
пример — кукушка) и др. Пути проникновения
паразитов в организм хозяина: пероральный,
перкутанный, контактный, внутрикишечный,
транспланцентарный, трансмиссивный,
трансовариальный.
[править]
Эволюция
Биотрофичный
паразитизм обычно является весьма
успешным приспособлением. В зависимости
от системы определений, около половины
известных видов животных имеют как
минимум одну паразитическую стадию в
своем жизненном цикле[источник не указан
436 дней]; также паразитизм довольно часто
встречается среди растений и грибов. С
другой стороны, практически все
свободноживущие виды животных являются
хозяевами одного или нескольких таксонов
паразитов.
Организмы-хозяева
обычно в ходе эволюции также изменяются;
у них появляются защитные механизмы
против паразитов. Растения часто
продуцируют токсины, которые могут
одновременно наносить эффективное
воздействие на паразитических грибов,
бактерий и растительноядных животных.
Иммунная система позвоночных способна
нейтрализовывать большинство паразитов
(особенно микропаразитов) при их контакте
с жидкостями организма.
С
другой стороны, большинство паразитов,
особенно микроорганизмов, эволюционно
приобрели адаптации для защиты от
противодействия хозяев. Такими адаптациями
могут быть утолщенные клеточные стенки
бактерий, клещи-захваты на конечностях,
предотвращающие вычесывание блох и
клещей из волосяного покрова, и т. д.
При
описанном типе взаимодействия оба вида
(хозяин и паразит) обычно совместно
эволюционируют к более-менее стабильному
состоянию, когда их влияние на численность
друг друга становится минимально
возможным (но из этого правила могут
быть и исключения — см. Паразитоиды).
Иногда
исследования паразитов помогает выявить
родственные связи между их хозяевами.
Например, длительный диспут орнитологов
относительно систематического положения
фламинго — являются ли они более
родственными с рядом Ciconiiformes
(Аистообразные) или Anseriformes
(Гусеобразные) — был решен благодаря
исследованию их паразитов, которые
оказались общими с таковыми у гусеобразных
(впрочем, исследования ДНК в последние
годы показало, что фламинго — не очень
близкие родственники и этого отряда).
Важно
отметить, что такие определения, как
«польза» и «вред», в случае паразитизма
иногда относятся не к отдельным индивидам,
а к виду в целом. Например, если при
поражении паразитом индивид становится
более сильным и выносливым, но теряет
функцию размножения (как это бывает при
поражении улитки некоторыми плоскими
червями), надо считать, что в эволюционном
смысле этот организм понес ущерб от
данного паразита. Сам по себе вред,
причиненный паразитом хозяину, может
варьировать в очень широких пределах:
от различного типа тканевых повреждений,
нарушений регуляторных механизмов к
гораздо более изощренным, таких как
изменение поведения хозяина. Негативное
воздействие инфекционных патогенных
микроорганизмов обычно связано с их
размножением в организме и воздействием
продуктов их жизнедеятельности на
хозяина.
[править]
Жизненный
цикл
Жизненный
цикл дизентерийной амебы
[править]
Вирусы
Вирусы
являются облигатными паразитами — они
не способны размножаться вне клетки.
Вирусы — сборная группа, не имеющая
общего предка. В настоящее время
существует несколько гипотез, объясняющих
происхождение вирусов. Считается, что
крупные ДНК-содержащие вирусы происходят
от более сложных (и, возможно, клеточных,
таких как современные микоплазмы и
риккетсии), внутриклеточных паразитов,
утративших значительную часть своего
генома
Карликовый
цепень (лат. Hymenolepis nana) — вид ленточных
червей отряда циклофиллид (Cyclophyllidea).
Половозрелые особи паразитируют в
кишечнике человека, намного реже у мышей
и крыс. Является одним из немногих
представителей ленточных червей, которые
могут осуществлять все стадии жизненного
цикла, не выходя из окончательного
хозяина.
Строение
взрослой стадии
Длина
тела половозрелой стадии (стробилы)
составляет 1—3 см. Состоит из головки
(сколекса) ( с 4 присосками и хобботком
с венчиком из 24-30 крючьев ), и до 200 члеников
(проглоттид). Сколекс переходит в
нечленистую шейку, от которой растут
членики, чем дальше членик, тем он старше.
Вначале идут незрелые членики, затем
гермафродитные, а последние (зрелые)
содержат матку, наполненную округлыми
или широкоовальными яйцами размером
до 40 мкм. Яйцо одето двумя прозрачными
оболочками, между которыми идут
извивающиеся нити — филаменты, отходящие
от утолщенных краев внутренней оболочки.
В яйце находится онкосфера диаметром
16-19 мкм, имеющая три пары крючьев.
Статья на конкурс «био/мол/текст»: Уже более 50 лет прошло с тех пор, как на культуре фибробластов доказан феномен старения клеток, но существование старых клеток в организме долгое время подвергалось сомнению. Не было доказательств, что старение отдельных клеток играет важную роль в старении всего организма. В последние годы были открыты молекулярные механизмы старения клеток, их связь с онкологическими заболеваниями и воспалением. По современным представлениям, воспаление играет ведущую роль в генезе практически всех возраст-зависимых заболеваний, которые в конечном итоге приводят организм к смертельному исходу. Оказалось, что старые клетки, с одной стороны, выступают в качестве супрессоров опухолей (поскольку необратимо перестают делиться сами и снижают риск трансформации окружающих клеток), а с другой — специфический метаболизм старых клеток может вызывать воспаление и перерождение соседних предраковых клеток в злокачественные. В настоящее время проходят клинические испытания лекарственных препаратов, избирательно элиминирующих старые клетки в органах и тканях, тем самым предотвращая дегенеративные изменения органов и рак.
В организме человека присутствует примерно 300 типов клеток, и все они делятся на две большие группы: одни могут делиться и размножаться (то есть, они митотически компетентны), а другие — постмитотические — не делятся: это достигшие крайней стадии дифференцировки нейроны, кардиомиоциты, зернистые лейкоциты и другие.
В нашем организме существуют обновляющиеся ткани, в которых есть пул постоянно делящихся клеток, которые заменяют отработанные или погибающие клетки. Такие клетки есть в криптах кишечника, в базальном слое эпителия кожи, в костном мозге (кроветворные клетки). Обновление клеток может происходить довольно интенсивно: так, клетки соединительной ткани в поджелудочной железе заменяются каждые 24 часа, клетки слизистой желудка — каждые три дня, лейкоциты — каждые 10 дней, клетки кожи — каждые шесть недель, примерно 70 г пролиферирующих клеток тонкого кишечника удаляется из организма ежедневно [1].
Стволовые клетки, существующие практически во всех органах и тканях, способны делиться неограниченно. Регенерация тканей происходит за счет пролиферации стволовых клеток, которые могут не только делиться, но и дифференцироваться в клетки той ткани, регенерация которой происходит. Стволовые клетки есть в миокарде, в головном мозге (в гипокампе и в обонятельных луковицах) и в других тканях. Это открывает большие надежды в плане лечения нейродегенеративных заболеваний и инфаркта миокарда [2–4].
Постоянно обновляющиеся ткани способствуют увеличению продолжительности жизни. При делении клеток происходит омоложение тканей: новые клетки приходят на место поврежденных, при этом интенсивнее происходит репарация (устранение повреждений ДНК) и возможна регенерация при повреждении тканей. Не удивительно, что у позвоночных значительно выше продолжительность жизни, чем у беспозвоночных — тех же насекомых, у которых во взрослом состоянии клетки не делятся.
Но в то же время обновляющиеся ткани подвержены гиперпролиферации, что ведет к образованию опухолей, в том числе — злокачественных. Это происходит из-за нарушений регуляции деления клеток и повышенной частоты мутагенеза в активно делящихся клетках. По современным представлениям, чтобы клетка приобрела свойство злокачественности, ей необходимо 4–6 мутаций . Мутации возникают редко, и для того, чтобы клетка стала раковой — это подсчитано для фибробластов человека — должно произойти около 100 делений (такое число делений обычно происходит у человека примерно в возрасте 40 лет) [5].
Стоит, в прочем, помнить, что мутация мутации рознь, и согласно новейшим геномным исследованиям в каждом поколении человек приобретает около 60 новых мутаций (которых не было в ДНК у его родителей). Очевидно, что большая часть из них вполне нейтральная (см. «Перевалило за тысячу: третья фаза геномики человека»). — Ред.
В целях защиты от самого себя, в организме сформировались специальные клеточные механизмы супрессии опухолей. Один из них — репликативное старение клеток (сенесценция), заключающееся в необратимой остановке деления клетки в стадии G1 клеточного цикла. При старении клетка перестает делиться: она не реагирует на ростовые факторы и становится устойчивой к апоптозу.
Лимит Хейфлика
Феномен старения клеток был впервые открыт в 1961 г. Леонардом Хейфликом с коллегами на культуре фибробластов. Оказалось, что клетки в культуре фибробластов человека при хороших условиях живут ограниченное время и способны удваиваться примерно 50±10 раз, — и это число стали называть лимитом Хейфлика [6], [7]. До открытия Хейфлика господствовала точка зрения, что клетки бессмертны, а старение и смерть — это свойство организма в целом.
Эта концепция считалась неопровержимой во многом благодаря экспериментам Карреля, который поддерживал культуру клеток сердца цыпленка 34 года (ее выбросили лишь после его смерти). Однако, как выяснилось впоследствии, бессмертие культуры Карреля было артефактом, поскольку вместе с эмбриональной сывороткой, которая добавлялась в культуральную среду для роста клеток, туда попадали и сами эмбриональные клетки (и, скорее всего, культура Карреля стала уже далеко не тем, чем была в начале).
По-настоящему бессмертными являются раковые клетки. Так, клетки HeLa, выделенные в 1951 г. из опухоли шейки матки Генриетты Лакс , до сих пор используются цитологами (в частности, c помощью клеток HeLa была разработана вакцина против полиомиелита). Эти клетки даже побывали в космосе.
О захватывающей истории бессмертия Генриетты Лакс см. в статье «Бессмертные клетки Генриетты Лакс», а также «Наследники клеток HeLa». — Ред.
Как выяснилось, лимит Хейфлика зависит от возраста: чем старше человек, тем меньшее число раз удваиваются его клетки в культуре. Интересно, что замороженные клетки при разморозке и последующем культивировании как будто помнят число делений до замораживания. Фактически, внутри клетки существует «счетчик делений», и по достижении определенного предела (лимита Хейфлика) клетка перестает делиться — становится сенесцентной. Сенесцентные (старые) клетки имеют специфическую морфологию — они крупные, уплощенные, с большими ядрами, сильно вакуолизированы, у них меняется профиль экспрессии генов. В большинстве случаев они устойчивы к апоптозу.
Однако старение организма нельзя свести только к старению клеток. Это значительно более сложный процесс. Старые клетки есть и в молодом организме, но их мало! Когда же с возрастом сенесцентные клетки накапливаются в тканях, начинаются дегенеративные процессы, которые приводят к возраст-зависимым заболеваниям. Один из факторов этих заболеваний — так называемое старческое «стерильное» воспаление, которое связано с экспрессией провоспалительных цитокинов старыми клетками.
Еще один важный фактор биологического старения — строение хромосом и их кончиков — теломеров.
Теломерная теория старения
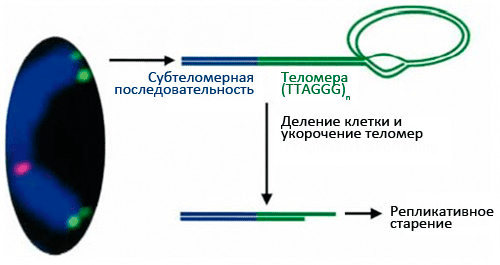
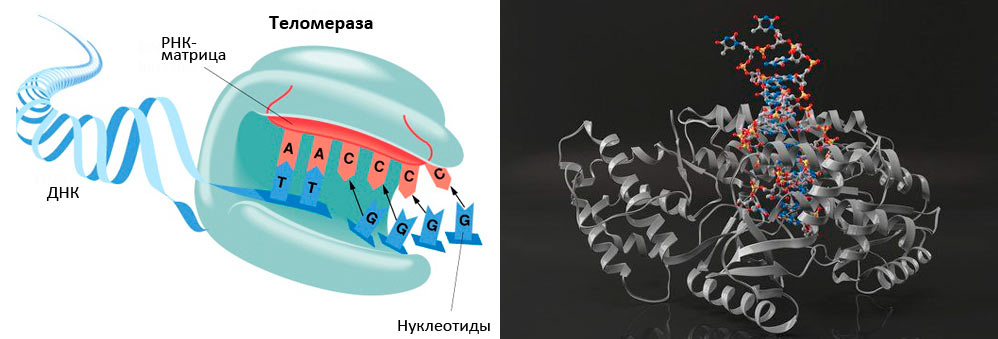
Рисунок 1. Теломеры — концевые участки хромосом. Поскольку хромосом у человека 23 пары (то есть, 46 штук), теломер получается 92.
В 1971 году наш соотечественник Алексей Матвеевич Оловников предположил, что лимит Хейфлика связан с «недорепликацией» концевых участков линейных хромосом (они имеют специальное название — теломеры). Дело в том, что в каждом цикле деления клетки теломеры укорачиваются из-за неспособности ДНК-полимеразы синтезировать копию ДНК с самого кончика [8], [9]. Кроме того, Оловников предсказал существование теломеразы (фермента, добавляющего повторяющиеся последовательности ДНК на концы хромосом), исходя из того факта, что иначе в активно делящихся клетках ДНК быстро бы «съелась», и генетический материал был бы утерян. (Проблема в том, что активность теломеразы угасает в большинстве дифференцированных клеток.)
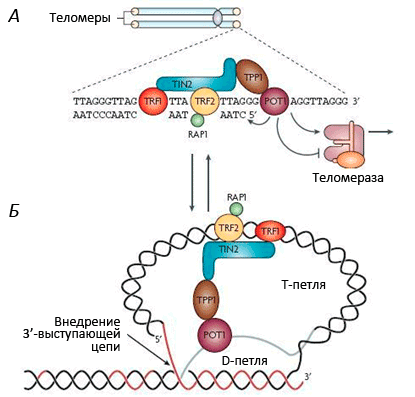
Теломеры (рис. 1) играют важную роль: они стабилизируют кончики хромосом, которые иначе, как говорят цитогенетики, стали бы «липкими», т.е. подверженными разнообразным хромосомным аберрациям, что приводит к деградации генетического материала. Теломеры состоят из повторяющихся (1000–2000 раз) последовательностей (5′—TTAGGG—3′), что в сумме дает 10–15 тысяч нуклеотидных пар на каждый хромосомный кончик. На 3′-конце теломеры имеют довольно длинный однонитевой участок ДНК (150–200 нуклеотидов), участвующий в образовании петли по типу лассо [10], [11] (рис. 2). С теломерами связано несколько белков, образующих защитный «колпачок» — этот комплекс называется шелтерином (рис. 3). Шелтерин предохраняет теломеры от действия нуклеаз и слипания и, видимо, именно он сохраняет целостность хромосомы.
Рисунок 2. Состав и структура теломер. Многократное деление клетки в случае отсутствия активности теломеразы ведет к укорочению теломер и репликативному старению.
Рисунок 3. Строение теломерного комплекса (шелтерина). Теломеры находятся на концах хромосом и состоят из тандемных повторов TTAGGG, которые заканчиваются 32-членным выступающим одноцепочечным фрагментом. С теломерной ДНК связан шелтерин — комплекс из шести белков: TRF1, TRF2, RAP1, TIN2, TPP1 и POT1.
Незащищенные концы хромосом воспринимаются клеткой как повреждение генетического материала, что активирует репарацию ДНК. Теломерный комплекс вместе с шелтерином «стабилизирует» хромосомные кончики, защищая всю хромосому от разрушения. В сенесцентных клетках критическое укорочение теломер нарушает эту защитную функцию [12], [13], в связи с чем начинают формироваться хромосомные аберрации, которые часто приводят к малигнизации. Чтобы этого не произошло, специальные молекулярные механизмы блокируют клеточное деление, и клетка переходит в состояние сенесцентности — необратимой остановки клеточного цикла. При этом клетка гарантированно не может размножаться, а значит, не сможет и сформировать опухоль. В клетках с нарушенной способностью к сенесценции (которые размножаются, несмотря на дисфункцию теломер), образуются хромосомные аберрации.
Длина теломер и скорость их укорочения зависит от возраста. У человека длина теломер варьирует от 15 тысяч нуклеотидных пар (т.н.п.) при рождении до 5 т.н.п. при хронических заболеваниях. Длина теломер максимальна у 18-месячных детей, а затем она быстро снижается до 12 т.н.п. к пятилетнему возрасту. После этого скорость укорачивания снижается [14].
Теломеры укорачиваются у разных людей с разной скоростью. Так, на эту скорость сильно влияют стрессы. Э. Блекберн (лауреат Нобелевской премии по физиологии и медицине 2009 г.) установлено, что женщины, постоянно испытывающие стресс (например, матери хронически больных детей), имеют значительно более короткие теломеры по сравнению со сверстницами (примерно на десять лет!). Лабораторией Э. Блекберн разработан коммерческий тест для определения «биологического возраста» людей на основании длины теломер.
Любопытно, что у мышей очень длинные теломеры (50–40 т.н.п., по сравнению с 10–15 т.н.п. у человека). У некоторых линий лабораторных мышей длина теломер достигает 150 т.н.п. Более того, у мышей теломераза всегда активна, что не дает теломерам укорачиваться. Однако это, как всем известно, не делает мышей бессмертными. Мало того: у них опухоли развиваются намного чаще, чем у людей, что позволяет предположить, что укорачивание теломер как механизм защиты от опухолей у мышей не работает [15].
При сравнении длины теломер и теломеразной активности у разных млекопитающих оказалось, что виды, для которых характерно репликативное старение клеток, имеют большую продолжительность жизни и большой вес. Это, например, киты, продолжительность жизни которых может достигать 200 лет. Таким организмам репликативное старение просто необходимо, поскольку слишком большое число делений порождает множество мутаций, с которыми необходимо как-то бороться. Предположительно, репликативное старение и есть такой механизм борьбы, который сопровождается к тому же репрессией теломеразы [16].
Старение диференцированных клеток происходит иначе. Стареют и нейроны, и кардиомиоциты, а ведь они не делятся! Например, в них накапливается липофусцин — старческий пигмент, который нарушает функционирование клеток и запускает апоптоз. В клетках печени и селезенки с возрастом накапливается жир.
Связь репликативного старения клеток со старением организма, строго говоря, не доказана, но возрастная патология сопровождается и старением клеток (рис. 4). Злокачественные новообразования пожилого возраста в большинстве своем связаны с обновляемыми тканями. Онкологические заболевания в развитых странах — одна из основных причин заболеваемости и смертности, причем независимым фактором риска раковых заболеваний является просто… возраст. Число смертей от опухолевых заболеваний увеличивается с возрастом по экспоненте, так же как и общая смертность. Это говорит нам, что между старением и канцерогенезом существует фундаментальная связь.
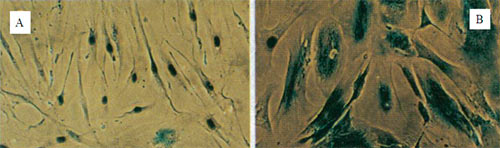
Рисунок 4. Гистохимически окрашенные на наличие β-галактозидазной активности фибробласты человека линии WI-38. A — молодые; B — старые (сенесцентные).
Теломераза — фермент, который был предсказан
В организме должен существовать механизм, компенсирующий укорочение теломер, — такое предположение сделал А.М. Оловников. Действительно, в 1984 г. такой фермент был открыт Кэрол Грейдер и назван теломеразой. Теломераза (рис. 5) — это обратная транскриптаза, которая увеличивает длину теломер, компенсируя их недорепликацию. В 2009 году Э. Блэкберн, К. Грэйдер и Д. Шостак за открытие этого фермента и цикл работ по изучению теломер и теломеразы была присуждена Нобелевская премия (см: «„Нестареющая“ Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе»).
Рисунок 5. Теломераза содержит каталитический компонент (обратную транскриптазу ТERT), теломеразную РНК (hTR или TERC), содержащую две копии теломерного повтора и являющуюся матрицей для синтеза теломеров, и белок дискерин.
По данным Э. Блекберн, теломераза участвует в регуляции активности примерно 70 генов. Теломераза активна в зародышевых и эмбриональных тканях, в стволовых и пролиферирующих клетках. Ее обнаруживают в 90% раковых опухолей, что обеспечивает неудержимое размножение раковых клеток. В настоящее время среди препаратов, которые используют для лечения рака, есть и ингибитор теломеразы. Но в большинстве соматических клеток взрослого организма теломераза не активна.
В состояние сенесценции клетку могут привести многие стимулы — дисфункция теломер, повреждения ДНК, причиной которых могут быть мутагенные воздействия окружающей среды, эндогенные процессы, сильные митогенные сигналы (сверхэкспрессия онкогенов Ras, Raf, Mek, Mos, E2F-1 и др.), нарушения хроматина, стрессы и др. Фактически, клетки перестают делиться — становятся сенесцентными — в ответ на потенциально вызывающие рак события.
Страж генома
Дисфункция теломер, которая происходит при их укорачивании либо нарушении работы шелтерина, активирует белок р53. Этот транскрипционный фактор приводит клетку в состояние сенесценции, либо вызывает апоптоз. При отсутствии р53 развивается нестабильность хромосом, характерная для карцином человека. Мутации в белке р53 обнаруживаются в 50% аденокарцином груди и в 40–60% случаев колоректальной аденокарциномы. Поэтому p53 зачастую называют «стражем генома».
Теломераза реактивируется в большинстве опухолей эпителиального происхождения, которые характерны для пожилых людей. Считается, что реактивация теломеразы — важный этап злокачественных процессов, поскольку это позволяет раковым клеткам «не обращать внимания» на лимит Хейфлика. Дисфункция теломер способствует хромосомным слияниям и аберрациям, что в отсутствии p53 чаще всего приводит к злокачественным новообразованиям.
О молекулярных механизмах старения клеток
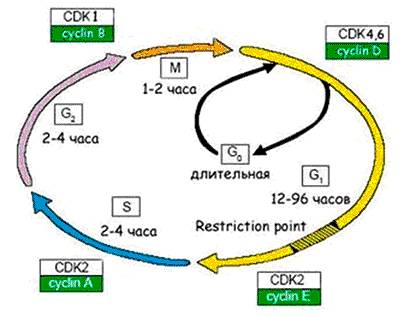
Рисунок 6. Схема клеточного цикла. Клеточный цикл подразделяют на четыре стадии: 1. G1 (предсинтетическая) — период, когда клетка готовится к репликации ДНК. В этой стадии может произойти остановка клеточного цикла в случае обнаружения повреждений ДНК (на время репарации). Если обнаруживаются ошибки в репликации ДНК, и они не могут быть исправлены репарацией, клетка не переходит на стадию S. 2. S (cинтетическая) — когда происходит репликация ДНК. 3. G2 (постсинтетическая) — подготовка клетки к митозу, когда происходит проверка точности репликации ДНК; если обнаружены недореплицированные фрагменты или другие нарушения в синтезе, переход на следующую стадию (митоз) не происходит. 4. М (митоз) — формирование клеточного веретена, сегрегация (расхождение хромосом) и формирование двух дочерних клеток (собственно деление).
Чтобы были понятны молекулярные механизмы перехода клетки в состояние сенесцентности, я напомню вам, как происходит деление клетки.
Процесс размножения клеток называют пролиферацией. Время существования клетки от деления до деления именуют клеточным циклом. Процесс пролиферации регулируется как самой клеткой — аутокринными ростовыми факторами, — так и ее микроокружением — паракринными сигналами.
Активация пролиферации происходит через клеточную мембрану, в которой присутствуют рецепторы, воспринимающие митогенные сигналы — это в основном ростовые факторы и межклеточные контактные сигналы. Ростовые факторы обычно имеют пептидную природу (к настоящему времени их известно около 100). Это, например, фактор роста тромбоцитов, который участвует в тромбообразовании и заживлении ран, эпителиальный фактор роста, различные цитокины — интерлейкины, фактор некроза опухолей, колониестимулирующие факторы и т.д. После активации пролиферации клетка выходит из фазы покоя G0 и начинается клеточный цикл [19] (рис. 6).
Клеточный цикл регулируется циклин-зависимыми киназами, разными для каждой стадии клеточного цикла. Они активируются циклинами и инактивируются рядом ингибиторов. Цель такой сложной регуляции — обеспечить синтез ДНК с как можно меньшим числом ошибок, чтобы и дочерние клетки имели абсолютно идентичный наследственный материал. Проверка правильности копирования ДНК осуществляется в четырех «контрольных точках» цикла: если обнаруживаются ошибки, то клеточный цикл останавливается, и включается репарация ДНК. Если нарушения структуры ДНК удается исправить — клеточный цикл продолжается. Если нет — клетке лучше «покончить с собой» (путем апоптоза), чтобы избежать вероятности превращения в раковую.
Молекулярные механизмы, приводящие к необратимой остановке клеточного цикла, контролируются генами-супрессорами опухолей, среди которых p53 и pRB, связанные с ингибиторами циклин-зависимых киназ. Супрессию клеточного цикла в фазе G1 осуществляет белок p53, действующий через ингибитор циклин-зависимой киназы р21. Транскрипционный фактор р53 активируется при повреждениях ДНК, и функция его заключается в удалении из пула реплицирующихся клеток тех, которые являются потенциально онкогенными (отсюда и прозвище р53 — «страж генома»). Данное представление подтверждается тем фактом, что мутации р53 обнаруживают в ~50% случаев злокачественных опохолей. Другое проявление активности р53 связано с апоптозом наиболее поврежденных клеток.
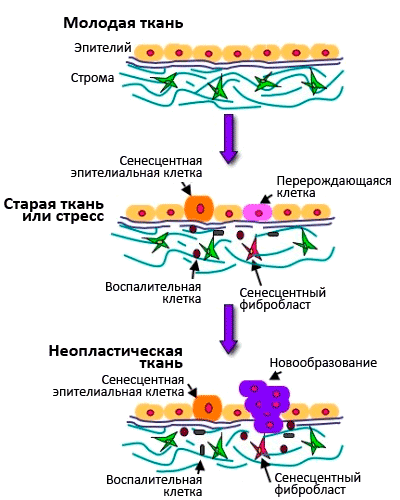
Сенесценция клеток и возраст-зависимые заболевания
Рисунок 7. Взаимосвязь между старением клеток и старением организма.
Сенесцентные клетки накапливаются с возрастом и способствуют возрастным заболеваниям. Они снижают пролиферативный потенциал ткани и истощают пул стволовых клеток, что приводит к дегенеративным нарушениям ткани и снижает способность к регенерации и обновлению.
Сенесцентные клетки характеризуются специфической экспрессией генов: они секретируют воспалительные цитокины и металлопротеиназы, разрушающие межклеточный матрикс. Получается, что старые клетки обеспечивают вялотекущее старческое воспаление, а накопление старых фибробластов в коже служит причиной возрастного снижения способности к заживлению ран (рис. 7). Старые клетки также стимулируют пролиферацию и малигнизацию близлежащих предраковых клеток, благодаря секреции эпителиального фактора роста [20].
Сенесцентные клетки накапливаются во многих тканях человека, присутствуют в атеросклеротических бляшках, в язвах кожи, в пораженных артритом суставах, а также в доброкачественных и пренеопластических гиперпролиферативных поражениях простаты и печени. При облучении раковых опухолей некоторые клетки также переходят в состояние сенесценции, тем самым обеспечивая рецидивы заболевания.
Таким образом, клеточное старение демонстрирует эффект отрицательной плейотропии, суть которого состоит в том, что хорошее для молодого организма, может стать плохим для старого. Самый яркий пример — процессы воспаления. Выраженная реакция воспаления способствует быстрому выздоровлению молодого организма при инфекционных заболеваниях. В пожилом же возрасте активные воспалительные процессы приводят к возрастным заболеваниям. Сейчас принято считать, что воспаление играет определяющую роль практически при всех возраст-зависимых заболеваниях, начиная с нейродегенеративных.
Получается парадокс: старение клеток в молодом организме предохраняет от рака, а в старом — способствует ему! В настоящее время в США в клинике Майо ведутся исследования влияния «ликвидации» старых клеток из организма. На животных получены обнадеживающие результаты об увеличении продолжительности жизни и замедлении клинических проявлений возраст-зависимых заболеваний, если из тканей старых животных селективно устранять сенесцентные клетки — хороших граждан, но плохих соседей.
- Alvaro Macieira-Coelho. (2011). Cell division and aging of the organism. Biogerontology. 12, 503-515;
- Была клетка простая, стала стволовая;
- Ствол и ветки: стволовые клетки;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Егоров Е.Е. Роль теломер и теломеразы в процессах клеточного старения и канцерогенеза: дис…. д. биол. наук. — Москва, 2003. — 300 с.;
- Hayflick L. and Moorhead P.S. (1961). The serial cultivation of human diploid cell strain. Exp. Cell Res. 25, 585–621;
- Jerry W. Shay, Woodring E. Wright. (2000). Hayflick, his limit and cellular ageing. Nat Rev Mol Cell Biol. 1, 72-76;
- Оловников А.М. (1971). Принцип маргинотомии в матричном синтезе полинуклеотидов. Докл. акад. наук СССР. 201, 1496–1499;
- A.M. Olovnikov. (1973). A theory of marginotomy. Journal of Theoretical Biology. 41, 181-190;
- Carol W Greider. (1994). Mammalian telomere dynamics: healing, fragmentation shortening and stabilization. Current Opinion in Genetics & Development. 4, 203-211;
- Коряков Д.Е. и Жимулев И.Ф. Хромосомы. Структура и функции. Новосибирск: СО РАН, 2009. — 256 с.;
- T. de Lange. (2005). Shelterin: the protein complex that shapes and safeguards human telomeres. Genes & Development. 19, 2100-2110;
- Yibin Deng, Sandy Chang. (2007). Role of telomeres and telomerase in genomic instability, senescence and cancer. Lab Invest. 87, 1071-1076;
- Frenck R.W.Jr., Blackburn E.H., Shannon K.M. (1998). The rate of telomere sequence loss in human leukocytes varies with age. Proc. Natl. Acad. Sci. U.S.A. 95, 5607–5610;
- Анисимов В.Н. Молекулярные и физиологические механизмы старения. СПб.: «Наука», 2008. — т. 1 с. 465, т. 2, с. 473;
- Gomes N.M.V., Shay J.W., Wright W.E. (2010). Telomeres and Telomerase. The Comparative Biology of Aging (ed. Wolf N.S.). Springer, p. 227–259;
- Jerry W. Shay, Woodring E. Wright. (2005). Senescence and immortalization: role of telomeres and telomerase. Carcinogenesis. 26, 867-874;
- Shay J.W., Wright W.E. (2001). Forward: aging and cancer: are telomeres and telomerase the connection? In: Telomerase, Aging and Disease (ed. Mattson M.P.). Baltimore, MD: Elsevier, p. 231;
- Фаллер В.М. и Шилдс Д. Молекулярная биология клетки. М.: «Бином-Пресс», 2006. — 235 с.;
- Judith Campisi. (2005). Senescent Cells, Tumor Suppression, and Organismal Aging: Good Citizens, Bad Neighbors. Cell. 120, 513-522;
- Masatoshi SUZUKI, David A. BOOTHMAN. (2008). Stress-induced Premature Senescence (SIPS). JRR. 49, 105-112.
- Авторы
- Файлы
- Литература
Мелихова Л.В.
1
Чентиева Л.А.
1
Лущик М.В.
1
1 Воронежский государственный медицинский университет им. Н.Н. Бурденко
1. Журавлева Т.П. Основы гериатрии: учеб. пособие для студентов учреждений сред. проф. образования. М.: ФОРУМ: ИНФРА. М., 2003. 271 с.
2. Лобачев А.Н. Биогенез митохондрий при дифференциации и старении клеток. ВИНИТИ 19.09.85, №6756-В85 Деп., 1985, с. 28.
3. https://ru.m.wikipedia.org/wiki/Старение_человека
4. Руководство по геронтологии и гериатрии: Клиническая гериатрия / Под редакцией В.Н. Ярыгина, А.С. Мелентьева. М.: ГЭОТАР-МЕД, 2003. 523 с.
Сегодня существует несколько альтернативных теорий, которые отчасти противоречат друг другу, а отчасти – дополняют. Современная биология уделяет проблеме старения очень большое внимание, и с каждым годом появляются новые факты, позволяющие глубже понять механизмы этого процесса.
Молекулярно-генетические теории. Гипотеза, согласно которой причиной старения являются изменения генетического аппарата клетки, является одной из наиболее признанных в современной геронтологии. Молекулярно-генетические теории подразделяются на две большие группы. Одни ученые рассматривают возрастные изменения генома как наследственно запрограммированные. Другие считают, что старение – результат накопления случайных мутаций. Отсюда следует, что процесс старения может являться или закономерным результатом роста и развития организма, или следствием накопления случайных ошибок в системе хранения и передачи генетической информации.
Теория свободных радикалов. Практически одновременно выдвинутая Д. Харманом (1956) и Н.М. Эмануэлем (1958), свободнорадикальная теория объясняет не только механизм старения, но и широкий круг связанных с ним патологических процессов (сердечно-сосудистых заболеваний, ослабления иммунитета, нарушений функции мозга, катаракты, рака и некоторых других). Согласно этой теории, причиной нарушения функционирования клеток являются необходимые для многих биохимических процессов свободные радикалы – активные формы кислорода, синтезируемые главным образом в митохондриях – энергетических фабриках клеток. Если очень агрессивный, химически активный свободный радикал случайно покидает то место, где он нужен, он может повредить и ДНК, и РНК, и белки, и липиды. Природа предусмотрела механизм защиты от избытка свободных радикалов: кроме супероксиддисмутазы и некоторых других синтезируемых в митохондриях и клетках ферментов, антиоксидантным действием обладают многие вещества, поступающие в организм с пищей – в том числе витамины А, С и Е. Регулярное потребление овощей и фруктов и даже несколько чашек чая или кофе в день обеспечат вам достаточную дозу полифенолов, также являющихся хорошими антиоксидантами. К сожалению, избыток антиоксидантов – например, при передозировке биологически активных добавок – не только не полезен, но может даже усилить окислительные процессы в клетках.
Старение – это ошибка. Гипотеза «старения по ошибке» была выдвинута в 1954 г. американским физиком М. Сциллардом. Исследуя эффекты воздействия радиации на живые организмы, он показал, что действие ионизирующего излучения существенно сокращает срок жизни людей и животных. Под воздействием радиации происходят многочисленные мутации в молекуле ДНК и инициируются некоторые симптомы старения, такие как седина или раковые опухоли. Из своих наблюдений Сцилард сделал вывод, что мутации являются непосредственной причиной старения живых организмов. Однако он не объяснил факта старения людей и животных, не подвергавшихся облучению. Его последователь Л. Оргель считал, что мутации в генетическом аппарате клетки могут быть либо спонтанными, либо возникать в ответ на воздействие агрессивных факторов – ионизирующей радиации, ультрафиолета, воздействия вирусов и токсических (мутагенных) веществ и т.д. С течением времени система репарации ДНК изнашивается, в результате чего происходит старение организма.
Теория апоптоза. Академик В.П. Скулачев называет свою теорию теорией клеточного апоптоза. Апоптоз – процесс запрограммированной гибели клетки. Как деревья избавляются от частей, чтобы сохранить целое, так и каждая отдельная клетка, пройдя свой жизненный цикл, должна отмереть и ее место должна занять новая. Если клетка заразится вирусом, или в ней произойдет мутация, ведущая к озлокачествлению, или просто истечет срок ее существования, то, чтобы не подвергать опасности весь организм, она должна умереть. В отличие от некроза – насильственной гибели клеток из-за травмы, ожога, отравления, недостатка кислорода в результате закупоривания кровеносных сосудов и т.д., при апоптозе клетка аккуратно саморазбирается на части, и соседние клетки используют ее фрагменты в качестве строительного материала. Самоликвидации подвергаются и митохондрии – изучив этот процесс, Скулачев назвал его митоптозом. Митоптоз происходит, если в митохондриях образуется слишком много свободных радикалов. Когда количество погибших митохондрий слишком велико, продукты их распада отравляют клетку и приводят к ее апоптозу. Старение, с точки зрения Скулачева, – результат того, что в организме гибнет больше клеток, чем рождается, а отмирающие функциональные клетки заменяются соединительной тканью. Суть его работы – поиск методов противодействия разрушению клеточных структур свободными радикалами. По мнению ученого, старость – это болезнь, которую можно и нужно лечить, программу старения организма можно вывести из строя и тем самым выключить механизм, сокращающий нашу жизнь. По мнению Скулачева, главная из активных форм кислорода, приводящих к гибели митохондрий и клеток – перекись водорода. В настоящее время под его руководством проходит испытания препарат SKQ, предназначенный для предотвращения признаков старения.
Теория соматических мутаций. Многие работы показали увеличение с возрастом числа соматических мутаций и других форм повреждения ДНК, предлагая репарацию (ремонт) ДНК в качестве важного фактора поддержки долголетия клеток. Повреждения ДНК типичны для клеток, и вызываются такими факторами как жёсткая радиация и активные формы кислорода, и потому целостность ДНК может поддерживаться только за счёт механизмов репарации. Действительно, существует зависимость между долголетием и репарацией ДНК, как это было продемонстрировано на примере фермента поли-АДФ-рибоза-полимеразы-1 (PARP-1), важного игрока в клеточном ответе на вызванное стрессом повреждение ДНК. Более высокие уровни PARP-1 ассоциируются с большей продолжительностью жизни.
Теория бактериальной интоксикации организма. Оригинальную гипотезу выдвинул выдающийся русский биолог И.И. Мечников (1845-1916), который считал старение результатом интоксикации организма продуктами обмена бактерий, обитающих в кишечном тракте, и продуктами азотистого обмена веществ самого организма (мочевая кислота). Образуются ядовитые вещества, в том числе — скатол, индол, фенол (карболовая кислота), крезол, кадаверин (трупный яд), тирамин и другие токсины.
Теломерная теория Оловникова. Во многих клетках человека утрата способности их к делению связана с утратой теломер на концах хромосом, после определённого количества делений. Это происходит из-за отсутствия фермента теломеразы, который обычно экспрессуется только у зародышевых и стволовых клеток. Недавно было обнаружено, что окислительный стресс также может иметь влияние на утрату теломер, значительно ускоряя этот процесс в определённых тканях.
В настоящее время нет основной теории старения, они все занимают важное место в науке.
Библиографическая ссылка
Мелихова Л.В., Чентиева Л.А., Лущик М.В. ОСНОВНЫЕ ТЕОРИИ СТАРЕНИЯ // Международный студенческий научный вестник. – 2016. – № 4-2.
;
URL: https://eduherald.ru/ru/article/view?id=16084 (дата обращения: 12.06.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)