Пересмотр стекол
Москва,
Духовской переулок, 22Б
350015,
Краснодар,
Северная ул, 315
198035,
Санкт-Петербург,
Межевой канал, д.4, лит.А
603155,
Нижний Новгород,
Большая Печёрская ул., д.26
Обновлено: 06 июля 2022
61732
При онкологических заболеваниях материал опухоли берут для гистологического или цитологического исследования. Это необходимо для подтверждения диагноза и определения тактики дальнейшего ведения пациента.
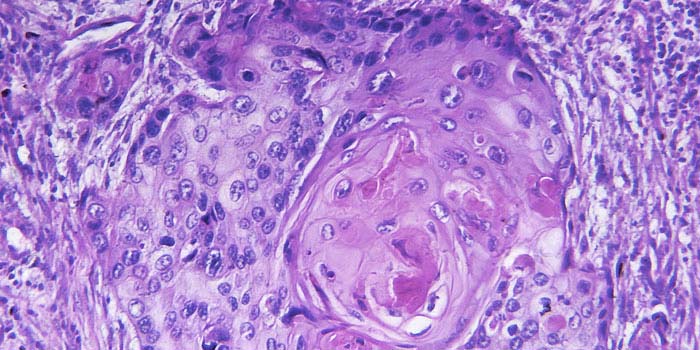
Пересмотр гистологических стекол: опухолевая ткань
Полученный во время операции или на биопсии образец ткани (или клеточный материал) специальным образом фиксируют и окрашивают, чтобы изучить под микроскопом и иммуногистохимическими методами. Последние позволяют даже определить органопринадлежность опухоли. [1]
Что такое блоки и стекла?
Эти термины обозначают ткань, полученную во время биопсии и подготовленную особым образом. В первую очередь образцы заливают раствором формалина и проводят специальную обработку. Это нужно для того, чтобы зафиксировать материал, чтобы клетки не разрушились. Затем ткани необходимо придать нужную степень плотности. Для этого ее помещают в парафин – так получаются гистологические блоки.
Гистологические блоки, образец ткани помещен в парафин
Но и такие образцы пока еще не готовы к исследованию. Ткань в блоке нельзя рассмотреть под микроскопом, потому что она не пропускает свет, а слои клеток накладываются друг на друга. Чтобы ткань стала прозрачной и доступной для изучения, блок нужно нарезать на очень тонкие слои с помощью специального инструмента – микротома. Эти тоненькие слои помещают на стекла и фиксируют – получаются гистологические стёкла. [2,3]
Гистологические стекла
Если у пациента обнаружен рак, то лаборатория обязана хранить гистологические блоки пожизненно, а если патологии не выявлено – в течение пяти лет. Гистологические стекла при диагностированном онкологическом заболевании тоже хранятся пожизненно. Если нужно выполнить пересмотр, то можно обратиться в лабораторию, где проводилось исследование, и получить оба этих вида материала. [4]
Когда и почему необходим пересмотр стекол?
Если морфологическое заключение не соответствует клинической картине опухоли, а также снимкам МРТ или КТ, то стекла отправляют на пересмотр в другое лечебное учреждение. Обычно пересмотром стекол занимаются специалисты с многолетним стажем работы и уникальным опытом диагностики редких опухолей. Дополнительный ручной пересмотр исключает возможность ошибки, связанной с использованием автоматических анализаторов.
Почему могут возникать ошибки при первичном просматривании стекол?
- неправильный забор материала, например, захвачен не весь слой эпителия, и невозможно судить о глубине поражения;
- проведена биопсия участка здоровой ткани;
- некачественная обработка материала в лаборатории;
- малое количество изученных срезов;
- недостаточная квалификация патоморфолога. [5]
Качественное микроскопическое и иммуногистохимическое исследование позволяет начать оправданное и своевременное лечение опухоли, а значит, увеличивает шансы на излечение и выживаемость пациента при онкологических заболеваниях. Оптимально, если морфологический диагноз будет подтвержден двумя специалистами.
Список литературы:
- Tatyana S. Gurina; Lary Simms. Histology, Staining. Treasure Island (FL): StatPearls Publishing; 2021 Jan-.
- В. А. Корьяк, Л. А. Николаева. Основы гистологической техники. Учебное пособие.
- Гистологическое изучение микропрепаратов тканей и органов. Гистология, эмбриология, цитология. Под ред. д.м.н., доц. Н. Ю. Матвеевой. Владивосток, Медицина ДВ, 2015.
- Приказ МЗ РФ № 179н от 24.03.2016 г. «О правилах проведения патолого-анатомических исследований».
- P. Morelli, E. Porazzi, M. Ruspini, U. Restelli, and G. Banfi. Analysis of errors in histology by root cause analysis: a pilot study. J Prev Med Hyg. 2013 Jun; 54(2): 90–96.
АНАЛИЗ ОШИБОК ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ДИСПЛАЗИЯ И РАК ЖЕЛУДКА
Анищенко В.В., Архипова А.А., Титов С.Е., Полоз Т.Л., Краснов О.А.
Новосибирский государственный медицинский университет, Клинический госпиталь «АВИЦЕННА» Группы компаний «Мать и дитя», Городская клиническая поликлиника № 1, АО «Вектор-Бест», ФГБУН «Институт молекулярной и клеточной биологии» СО РАН, Новосибирский государственный
университет, ЧУЗ «Клиническая больница «РЖД-Медицина», г. Новосибирск, Россия,
Кемеровский государственный медицинский университет, г. Кемерово, Россия
АНАЛИЗ ОШИБОК ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ДИСПЛАЗИЯ И РАК ЖЕЛУДКА
Рак желудка на IV стадии выявляется
в 38,9 %, для повышения точности эзофагогастродуоденоскопии с биопсией
перспективным видится дополнительно использовать молекулярные маркеры на основе
РНК.
Цель
исследования –
анализ ошибок дифференциальной диагностики язвы с дисплазией и рака желудка при
использовании эндоскопического, гистологического метода и классификатора
основного на профилировании миРНК.
Материалы
и методы.
Был проведен ретроспективный анализ результатов эндоскопического и
морфологического исследований 89 наблюдений пациентов с язвами желудка с
дисплазией, и молекулярно-генетическое исследование образцов архивного
гистологического материала в виде парафиновых блоков этих пациентов.
Проспективное исследование заключалось в повторных эндоскопических исследованиях
через 3, 6, 9, 12, 24 месяцев, а также мы наблюдали больных при помощи
электронной базы БАРС Медицинской информационной системой.
Результаты. Средний
промежуток времени до выявления злокачественного характера язвенного поражения
составил 11 месяцев, при этом выявлено 8 случаев (8,9 %) рака
желудка, из восьми 4 случая (4,5 %) – это несвоевременно выявленный
рак, инфильтративно-язвенная форма. В двух случаях из четырех раков
классификатор, основанный на профилировании миРНК, отнес поражения в группу
рака. 7 из 8 язвенных поражений в описании эндоскопического осмотра
охарактеризованы как гигантские, то есть больше 3,0 см.
Выводы. При выявлении
профиля миРНК, соответствующего раку желудка, необходимо вести пациента более
агрессивно, после снятия угрозы рецидива кровотечения провести повторную
эзофагогастродуоденоскопию с мультифокальной биопсией.
Ключевые
слова:
язва; дисплазия; рак; миРНК; диагностика
Anischenko V.V., Arkhipova A.A., Titov S.E., Poloz T.L., Krasnov O.A.
Novosibirsk State Medical University, Clinical Hospital «AVICENNA» of the Group of Companies «Mother and
Child», City Clinical Polyclinic N 1, JSC «Vector-Best», FSBSI Institute of Molecular and Cellular Biology SB RAS, Novosibirsk State University, Clinical Hospital Russian Railways-Medicine, Novosibirsk, Russia,
Kemerovo State Medical University, Kemerovo, Russia
ANALYSIS OF ERRORS IN DIFFERENTIAL DIAGNOSTICS OF DYSPLASIA AND STOMACH
CANCER
IV stage stomach cancer is detected in 38.9 % of cases; additional
use of RNA-based markers seems to be a promising way to improve the accuracy of
esophagogastroduodenoscopy with biopsy.
Objective of the study – analysis of errors in differential diagnostics of ulcers with dysplasia
and stomach cancer using the endoscopic and histological methods, and a
classification based on miRNA profiling.
Materials and methods. We carried out a retrospective analysis of the results of endoscopic
and morphological studies of 89 observations of patients with stomach
ulcers with dysplasia and performed a molecular genetic study of samples of
archival histological material of these patients in the form of paraffin
blocks. The prospective study consisted in repeated endoscopic examinations
after 3, 6, 9, 12, 24 months, and we also observed patients using the
electronic database BARS Medical Information System.
Results. The
average time before the detection of the malignant nature of the ulcerative
lesion was 11 months. There were detected 8 cases (8.9 %) of
stomach cancer, 4 cases out of which (4.5 %) were untimely detected
infiltrative ulcerative cancer. In two cases out of four the lesions were
attributed to the cancer group according to the classification based on siRNA
profiling. 7 out of 8 ulcerative lesions in the description of the
endoscopic examination are described as giant, that is, more than 3.0 cm.
Conclusions. When a miRNA profile corresponding to stomach cancer is identified, it
is necessary to lead the patient more aggressively, after removing the threat
of recurrent bleeding, repeat esophagogastroduodenoscopy with multifocal
biopsy.
Key words: ulcer; dysplasia; cancer; miRNA; diagnostics
По данным GLOBOCAN,
в 2018 году рак желудка занял второе место как причина смерти среди 36 видов
рака в 185 странах мира [1]. Однако организованные программы скрининга
существуют только в Японии и Южной Корее, для Азиатско-Тихоокеанского региона
это необходимая мера, так как около 60 % выявленных случаев рака желудка
приходятся на страны Восточной Азии [2].
Гастроканцероген 1 класса Helicobacter pylori
участвует в том числе в патогенезе гастродуоденальных язв, и появление язвы в
желудке сопряжено с риском злокачественной трансформации. Но в источниках
литературы частота малигнизации язвы, выявленная при эзофагогастродуоденоскопии,
значительно варьирует, от 6 до 21 % [3, 4]. Вследствие этого возник
вопрос: нуждаются ли пациенты с язвой желудка в контрольных эндоскопических
осмотрах? В Великобритании, согласно рекомендациям NICE
(National Institute for Health and
Clinical Excellence),
необходимо выполнять повторную гастроскопию через 8 недель всем пациентам
с язвой желудка, а вот Американское общество гастроинтестинальной эндоскопии,
напротив, советует проводить эзофагогастродуоденоскопию только в отдельных
клинических ситуациях. Selinger CP et
al. считают, что контрольные эндоскопические
исследования уменьшают количество диагностических ошибок и, вероятно, являются
главной причиной разброса данных о частоте злокачественной трансформации [3].
В «Золотой стандарт» диагностики рака и
предраковых поражений желудка входит гистологическое исследование биоптатов,
полученных при эзофагогастродуоденоскопии, но сама эндоскопическая диагностика
является инвазивным, дорогим методом, к тому же от врача, выполняющего
исследования, требуются специализированные знания, навыки и опыт работы,
особенно при выявлении ранних форм. Из-за вышеуказанных причин и бессимптомного
течения рак желудка часто выявляется на поздней стадии (IV стадия 38,9 %) и, как следствие, в первый
год с момента установления диагноза летальность составляет 45,8 % [5].
В то же время, ранняя диагностика рака и
его своевременное лечение обеспечивает выживаемость в более чем 90 %
наблюдений. Онкомаркеры (альфа-фетопротеин, СА-19-9, СА-125,
карциноэмбриональный антиген) не работают для выявления раннего рака. Поэтому
поиск новых инструментов по-прежнему актуален. В качестве перспективных
биомаркеров ранней диагностики злокачественной трансформации рассматривают
миРНК, они регулируют все процессы жизнедеятельности клетки, к тому же
стабильны и легко извлекаются из различных биологических материалов и даже из
парафиновых блоков. Немаловажно, что профили экспрессии миРНК неопластической
ткани отличаются при сравнении с профилем экспрессии миРНК нормальной ткани
[6].
Цель
настоящего исследования – анализ ошибок дифференциальной диагностики язвы с
дисплазией и рака желудка при использовании эндоскопического, гистологического
исследования и классификатора, основанного на профилировании миРНК.
МАТЕРИАЛЫ И МЕТОДЫ
Был проведен ретроспективный анализ
результатов эндоскопического и морфологического исследований 89 пациентов
с язвами желудка с дисплазией, и молекулярно-генетическое исследование образцов
архивного гистологического материала в виде парафиновых блоков этих пациентов.
До выполнения молекулярно-генетического исследования проведена независимая
экспертная оценка гистологических образцов. Уровень экспрессии микроРНК
определялся с помощью полимеразной цепной реакции с обратной транскрипцией в
реальном времени (ОТ-ПЦР РВ). Стратификацию образцов на разные группы проводили
с помощью алгоритма построения дерева принятия решений C-RT. Выделение РНК, выявление микроРНК и стратификация
образцов на разные группы описано ранее [7, 8]. Проспективное исследование
заключалось в повторных эндоскопических исследованиях через 3, 6, 9, 12, 24 месяцев,
а также мы наблюдали больных при помощи электронной базы БАРС Медицинской
информационной системы. От всех пациентов получены информированные согласия. В
результате выявлено 8 (8,9 %) случаев рака желудка, средний возраст
больных раком 59 + 5,4 лет, гендерное распределение: мужчин – 5 (62,5 %),
женщин – 3 (37,5 %).
РЕЗУЛЬТАТЫ
Учитывая малое количество наблюдений,
каждому распознанному случаю злокачественного новообразования (ЗНО) присвоен
порядковый номер, далее проведен подробный анализ. Главные результаты
представлены в таблице 1.
Таблица. Характеристика
выявленных случаев злокачественных новообразований желудка
Table. Characteristics of the identified cases of malignant
neoplasm in stomach
|
№ |
Архивный гистологический материал, заключение: Язва |
Диагностирован рак желудка |
Размер язвенного поражения желудка |
Гистологический диагноз |
Стадирование по TNM |
Оперативное лечение |
|
1 |
Январь 2017 |
Май 2020 |
4,0 см в диаметре |
Низкодифференцированная аденокарцинома |
T3NxMo |
_______ |
|
2 |
Август 2017 |
Октябрь 2017 |
4,0×5,0 см |
Умеренно дифференцированная аденокарцинома |
TxNxM1 |
_______ |
|
3 |
Ноябрь 2017 |
Декабрь 2019 |
3,5×4,0 см |
Низкодифференцированная аденокарцинома |
TxNxM1 |
_______ |
|
4 |
Декабрь 2017 |
Март 2018 |
4,0 см в |
Умеренно дифференцированная аденокарцинома |
TxNxMо |
_______ |
|
5 |
Январь 2018 |
Март 2018 |
2,5 см в диаметре |
Высокодифференцированная аденокарцинома |
T1aNoMo |
Субтотальная дистальная резекция + D 2 |
|
6 |
Март 2018 |
Апрель 2018 |
6,0×9,0 см |
Низкодифференцированная аденокарцинома |
TxNxM1 |
_______ |
|
7 |
Август 2018 |
Ноябрь 2019 |
5,0 см в диаметре |
Умеренно дифференцированная аденокарцинома |
T4аN1Mо (после операции) |
Субтотальная дистальная резекция + D 2 |
|
8 |
Сентябрь 2018 |
Октябрь 2018 |
5,0×3,5 см |
Низкодифференцированная аденокарцинома |
T2-3N1Mо (после операции) |
Гастрэктомия + D2 |
Четыре случая (2, 4, 6, 
выявленный рак желудка, инфильтративно-язвенная форма. Госпитализация
наблюдений (2, 4, 6, 
желудочно-кишечного кровотечения в хирургическое отделение, в день
госпитализации при эзофагогастродуоденоскопии был выявлен гигантский, более 3,0 см,
язвенный дефект с признаками нестабильного гемостаза, после эндоскопического
исследования больных переводили в отделение. На 5-е сутки со дня госпитализации
выполнялось повторное эндоскопическое исследование, однако в дне язвенного
дефекта определялись мелкие тромбированные сосуды (чёрные точки), из-за риска
рецидива кровотечения мультифокальная биопсия не проводилась, манипуляция
ограничивалась забором 1-2 фрагментов, а после выписки рекомендовалось
пройти гастроскопию с биопсией.
Случай
№ 1.
В январе 2017 года госпитализация по неотложным показаниям с клиникой
желудочно-кишечного кровотечения в хирургическое отделение, по данным первого
эндоскопического осмотра в антральном отделе найдена язва размером 1,2 см Forrest 2С, через 5 дней выполнена
повторная гастроскопия с биопсией. В описании эзофагогастродуоденоскопии
указано, что язвенный дефект уменьшился до 0,9 см, а в дне язвы появился
регенерирующий эпителий. При морфологическом исследовании получено заключение –
хронический периульцерозный гастрит с фокусами low-grade дисплазии. В мае 2020 года (через 41 месяц)
больная поступила по скорой помощи с диагнозом желудочно-кишечное кровотечение.
В периоде госпитализации было выявлено злокачественное образование желудка,
гистологическое заключение – Низкодифференцированная аденокарцинома. Ввиду тяжёлой
коморбидности специализированное лечение пациентке было противопоказано.
Случай
№ 3.
В ноябре 2017 года амбулаторное обращение с астеническим синдромом, был
направлен на эзофагогастродуоденоскопию, на которой выявили язву
препилорического отдела с субкомпенсированным стенозом привратника, выполнили
щипцовую биопсию, получены 3 фрагмента ткани из язвенного дефекта. Пациент
был проконсультирован хирургом, ему рекомендовали хирургическое лечение, на
которое он согласился. Однако в ходе подготовки к плановой госпитализации на
фоне консервативной терапии стеноз привратника был купирован, и пациент
отказался от операции несмотря на то, что при морфологическом исследовании
обнаружили фокусы high-grade дисплазии. Вновь обратился к участковому терапевту
в декабре 2019 года (через 26 месяцев) с жалобами на снижение массы и
увеличение размера живота. При ультразвуковом исследовании органов брюшной
полости найдены метастазы в печени и асцит.
Случай
№ 5.
В январе 2018 года госпитализация по экстренным показаниям с
желудочно-кишечным кровотечением, выполнен эндоскопический гемостаз. Перед
выпиской из стационара больной прошёл в плановом порядке гастроскопию с биопсией
для проведения гистологического исследования. В результате получено заключение:
Хроническая язва с high-grade дисплазией и началом регенерации. Пациент выписан
из стационара и направлен к онкологу.
Случай
№ 7.
На фоне приёма кардиомагнила в стандартной дозе больной начал испытывать боли в
эпигастрии, был направлен участковым терапевтом на эзофагогастродуоденоскопию,
при которой найден язвенный дефект овальной формы, размером до 1,0 см,
большую часть дна язвы покрывал регенерирующий эпителий, а фибрин составлял
примерно одну треть. Выполнена биопсия, гистологическое заключение – Хроническая
язва, регенерация. Через 15 месяцев больной поступил по экстренным
показаниям с желудочно-кишечным кровотечением, при эндоскопическом исследовании
найдена язва 4,0 × 5,0 см, после стабилизации гемостаза выполнена
повторная гастроскопия с биопсией, морфологическое исследование показало периульцерозный
гастрит с очагами кишечной метаплазии и фокусами high-grade дисплазии. Пациент выписан из стационара и
направлен к онкологу.
Наблюдения № 1, № 3, № 5,
№ 7 объединяет длительный язвенный анамнез, в каждом случае более 5 лет.
В первые 12 месяцев после установления диагноза рака желудка умерли все
пациенты, кроме случаев заболевания № 5 и № 7. Все образцы архивного
гистологического материала вошли в исследование, имея заключение: Язва с
дисплазией, при использовании разработанного нами метода по профилю экспрессии
миРНК [7, 8] в 2-х случаях (№ 4, № 6), классификатор отнёс поражения
желудка в группу рак. Библиотека случаев метода построения математической
модели, основанного на профилировании миРНК, уже превышает 340 случаев,
при этом при выявлении рака чувствительность 97,14 % и специфичность 97,55 %,
а для дисплазии чувствительность 95,35 %, специфичность 95,65 %, что
подтверждает необходимость применения миРНК при каждом выявленном случае
дисплазии. При этом в качестве альтернативы щипцовой биопсии можно использовать
браш-биопсию. Она менее травматична [9], при исследовании материала с
браш-препарата профиль миРНК оказался идентичным профилю миРНК, полученному с
гистологического материала одного и того же больного.
ОБСУЖДЕНИЕ
Средний промежуток времени до выявления
злокачественного характера язвенного поражения желудка в исследуемых случаях
составил 11 месяцев. 7 из 8 язвенных поражений в описании эндоскопического
осмотра охарактеризованы как гигантские, то есть больше 3,0 см, а размер
язвы считается одним из главных параметров, который позволяет врачу-эндоскописту
заподозрить злокачественное поражение [10]. Однако, несмотря на размер
язвенного дефекта и наличие дисплазии в гистологическом заключении, больные не
взяты под пристальное наблюдение хирурга и эндоскописта. Также у 5 пациентов
(62,5 %) биопсия ограничивалась 1-2 фрагментами, так как увеличение
количества биоптатов могло привести к рецидиву кровотечения, а из-за
инвазивного характера гастроскопии больные неохотно идут в плановом порядке на
повторные эндоскопические исследования. Всё это затрудняет интерпретацию данных
исследования и не позволяет поставить диагноз рак. Очевидно, что не существует
метода диагностики, которым можно на 100 % подтвердить диагноз рак. В
последние 10 лет всё чаще появляются публикации, в которых рекомендуется
для повышения точности и дифференциальной диагностики использовать молекулярные
маркеры на основе ДНК и РНК [6, 10]. В нашем исследовании, несмотря на то, что
не была проведена мультифокальная биопсия, два пациента с
инфильтративно-язвенным раком по образцам, полученным при первой
эзофагогастрододеноскопии, всё-таки были классифицированы с помощью
предложенного набора миРНК как рак. Это обнадёживает, но требуются дальнейшие
исследования.
ВЫВОДЫ:
1. При
выявлении на эзофагогастродуоденоскопии гигантской язвы с признаками
неустойчивого гемостаза целесообразно заменить мультифокальную щипцовую биопсию
на браш-биопсию, профиль экспрессии миРНК, полученный с браш-препарата и
гистологического материала у одного и того же больного, идентичен.
2.
При выявлении профиля миРНК, соответствующего раку желудка, необходимо вести
пациента более агрессивно, после снятия угрозы рецидива кровотечения провести
повторную эзофагогастродуоденоскопию с мультифокальной биопсией.
Информация о финансировании и конфликте интересов
Исследование не имело
спонсорской поддержки.
Авторы декларируют
отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией
настоящей статьи.
ЛИТЕРАТУРА / REFERENCES:
1. Bray F, Ferlay J,
Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018:
GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries.
CA Cancer J Clin. 2018; 68(6): 394-424.
doi: 10.3322/caac.21492
2. Asaka M, Kato M, Sakamoto
N. Roadmap to eliminate gastric cancer with Helicobacter pylori eradication and
consecutive surveillance in Japan. J
Gastroenterol. 2014; 49(1): 1-8. doi: 10.1007/s00535-013-0897-8
3. Selinger CP, Cochrane R,
Thanaraj S, Sainsbury A, Subramanian V, Everett S. Gastric ulcers: malignancy
yield and risk stratification for follow-up endoscopy. Endosc Int Open. 2016; 4(6): E709-14. doi: 10.1055/s-0042-106959
4. Muro EA, Celaya FB, Virseda
JMMP, Aguilar EB, Legaz SO, Pérez FJJ. Analysis of the clinical benefits and
cost-effectiveness of performing a systematic second-look gastroscopy in benign
gastric ulcer. Gastroenterol Hepatol.
2009; 32(1): 2-8. doi: 10.1016/j.gastrohep.2008.07.002
5. Statua of cancer the
population of Russia in 2019 /ed. Caprina AD, Starinsky VV, Shahzadova АО. M.:
P.A. Hertsen Moscow Oncology Research Center. 2020. 239 p. Russian (Состояние
онкологической помощи населению России в 2019 году /под ред. Каприна А.Д,
Старинского В.В., Шахзадова А.О. М.: МНИОИ им. П.А. Герцена, 2020. 239 с.)
6. Link A, Schirrmeister W,
Langner C, Varbanova M, Bornschein J, Wex T, Malfertheiner P. Differential
expression of microRNAs in preneoplastic gastric mucosa. Scientific Reports. 2015; 5: 8270. doi: 10.1038/srep08270
7. Titov SE, Anishchenko VV,
Poloz TL, Veryaskina YuA, Arkhipova AA, Ustinov SN. Differential Diagnostics of
Gastric Cancer and Precancerous Changes of the Gastric Mucosa Using Analysis of
Expression of Six Micrornas. Russian Clinical Laboratory Diagnostics. 2020; 65(2):
131-136. Russian (Титов С.Е., Анищенко В.В., Полоз Т.Л., Веряскина
Ю.А.,Архипова А.А., Устинов С.Н. Возможности дифференциальной диагностики рака
желудка и предраковых изменений слизистой желудка с помощью анализа экспрессии
шести микроРНК //Клиническая лабораторная диагностика. 2020. Т. 65, № 2. С. 131-136.) doi: 10.18821/0869-2084-2020-65-2-131-136
8. Anishchenko VV, Titov SE,
Poloz TL, Veryaskina YuA, Arkhipova AA, Bubnov IV. Dinamic screening of
precancerous esophagus using molecular genetic analysis. Siberian Journal of Oncology. 2020; 19(6): 38-45. Russian (Анищенко В.В., Титов С.Е., Полоз Т.Л.,
Веряскина Ю.А., Архипова А.А., Бубнов И.В. Динамический скрининг предраковых состояний
пищевода с помощью молекулярно-генетического анализа //Сибирский онкологический
журнал. 2020. Т. 19, № 6. С. 38-45.) doi: 10.21294/1814-4861-2020-19-6-38-45
9. Arkhipova AA, Anischenko
VV. Characteristic of Stomach Ulcers, Complicated by Bleeding. Acta Biomedica Scientifica. 2020; 5(1): 42-46.
Russian (Архипова А.А., Анищенко В.В. Характеристика язв желудка, осложнённых кровотечением //Acta Biomedica Scientifica. 2020. Т. 5, № 1. С. 42-46.) https://doi.org/10.29413/ABS.2020-5.1.5
10. Lord R, El-Feki M, Tomos L,
Mohammed N, Subramanian V, Rembacken BJ. Giant gastric ulcers: Malignancy yield
and predictors from a 10-year retrospective single centre cohort. United European Gastroenterol J. 2018; 6(7):
1000-1006. doi: 10.1177/2050640618770013
11. Hu B, Hajj NE, Sittler S,
Lammert N, Barnes R, Meloni-Ehrig A. Gastric cancer: Classification, histology
and application of molecular pathology. J Gastrointest
Oncol. 2012; 3(3): 251-261.
doi: 10.3978/j.issn.2078-6891.2012.021
Корреспонденцию
адресовать:
АРХИПОВА Анна Александровна
630005, г. Новосибирск, ул. Лермонтова,
д. 40. Тел.: 8 (383) 201-48-88
E-mail: ierusalimova@gmail.com
Сведения
об авторах:
АНИЩЕНКО Владимир Владимирович
доктор
мед. наук, профессор, зав. кафедрой хирургии факультета усовершенствования
врачей, ФГБОУ ВО НГМУ Минздрава России; главный специалист по хирургии,
Клинический госпиталь «АВИЦЕННА» Группы компаний «Мать и дитя», г. Новосибирск,
Россия
E-mail: AVV1110@yandex.ru ORCID:
0000-0003-1178-5205
АРХИПОВА Анна Александровна
канд. мед.
наук, врач-эндоскопист, отделение хирургического дневного стационара, ГАУЗ НСО
«ГКП № 1», г. Новосибирск, Россия
E-mail: ierusalimova@gmail.com ORCID: 0000-0001-5653-2960
ТИТОВ Сергей Евгеньевич
канд. биол.
наук, ст. науч. сотрудник лаборатории ПЦР, АО «Вектор-Бест»; ст. науч.
сотрудник лаборатории молекулярной генетики, ФГБУН ИМКБ СО РАН; инженер
лаборатории структурной, функциональной и сравнительной геномики, НГУ, г.
Новосибирск, Россия.
ORCID: 0000-0001-9401-5737.
ПОЛОЗ Татьяна Львовна
доктор мед. наук,
зав. цитологической лабораторией, ЧУЗ «КБ» РЖД-Медицина, г. Новосибирск,
Россия
ORCID: 0000-0003-4006-7560.
КРАСНОВ Олег Аркадьевич
доктор мед.
наук, профессор, кафедра факультетской хирургии и урологии, ФГБОУ ВО КемГМУ
Минздрава России, г. Кемерово, Россия
ORCID: 0000-0002-5214-7771
Information about authors:
ANISHCHENKO Vladimir Vladimirovich
doctor of medical sciences,
professor, head of the department of surgery, faculty of advanced training for
physicians, Novosibirsk State Medical University; chief specialist in surgery,
Clinical Hospital «AVICENNA» of the Group of Companies «Mother and Child»,
Novosibirsk, Russia
E-mail: AVV1110@yandex.ru ORCID: 0000-0003-1178-5205
ARKHIPOVA Anna Aleksandrovna
candidate of medical sciences,
endoscopist, department of surgical day hospital, City Clinical Polyclinic N 1,
Novosibirsk, Russia
E-mail: ierusalimova@gmail.com ORCID: 0000-0001-5653-2960.
TITOV Sergey Evgenievich
candidate of biological sciences, senior
researcher, PCR laboratory, Vector-Best JSC; senior researcher, laboratory of
molecular genetics, Institute of Molecular and Cellular Biology SB RAS;
engineer, structural, functional and comparative genomics laboratory,
Novosibirsk State University, Novosibirsk, Russia
ORCID: 0000-0001-9401-5737.
POLOZ Tatyana Lvovna
doctor of medical sciences, head of the cytology
laboratory, ChUZ «Clinical Hospital» Russian Railways Medicine, Novosibirsk,
Russia
ORCID: 0000-0003-4006-7560.
KRASNOV Oleg Arkadevich
doctor of medical sciences, professor,
department of faculty surgery and urology, Kemerovo State Medical University,
Kemerovo, Russia
ORCID: 0000-0002-5214-7771
Статистика просмотров
Ссылки
- На текущий момент ссылки отсутствуют.
Важные факты о раке желудка и пищевода. Рассказывает врач
12.03.2018
На вопросы о профилактике, диагностике и лечении рака желудка и пищевода отвечает руководитель онкологического центра комбинированных методов лечения клиники высоких медицинских технологий им. Н. И. Пирогова СПбГУ Андрей Павленко.
Рак желудка и рак пищевода — заболевания, идущие в связке?
Нет, это не так. Рак желудка и рак пищевода — заболевания, которые входят в разные группы риска и провоцируются разными факторами.
Что может спровоцировать рак желудка и рак пищевода?
Рак пищевода могут спровоцировать: многолетнее курение, любовь к горячим напиткам, частое (несколько раз в неделю) употребление крепких спиртных напитков. Почему? Они травмируют слизистую оболочку пищевода, провоцируют предраковые состояния. От курения никотин и смолы растворяются в слюне, крепкий алкоголь раздражает и вызывает воспалительные процессы.
Не так давно типичным эндемическим районом была Средняя Азия с ее любовью к горячему чаю. Его пили не остужая, и это приводило к заболеваниям среднегрудного отдела пищевода. Так что стоит пить и есть горячее, предварительно остудив во рту, либо охладив заранее до приемлемой температуры.
Рак желудка может быть вызван возбудителем helicobacter pylori. Он может довести слизистые оболочки до воспаления, которые потом трансформируются в метаплазии (изменения эпителия). Также в группу риска входят люди, употребляющие необработанные мясо и рыбу. Стоит помнить, что жареное и жирное скорее увеличит вероятность колоректального рака, нежели рака желудка.

Правда ли, что рак желудка и рак пищевода — болезни пожилых людей?
По большей части — да. Если говорить о пищеводе, 99% больных — люди старше пятидесяти, многолетние курильщики, употребляющие много крепкого алкоголя. Если каждый день употреблять крепкий алкоголь, слизистая оболочка не будет успевать восстанавливаться. А со временем репаративные процессы замедляются. Но если ваши близкие не пьют, но при этом много и давно курят, то это тоже повод провериться.
Порядка 15-20% заболевших раком желудка — пациенты до 50 лет. Есть совсем ранние формы — у тридцатилетних. Достаточно часто молодой возраст сочетается с агрессивными формами рака. Как правило, выживаемость у таких больных достаточно низкая. Это преимущественно недифференцированные формы рака — перстневидноклеточные, диффузные и так далее.
На какой стадии чаще всего обнаруживают эти виды рака?
Если опухоль агрессивна, то на любой стадии может произойти ее генерализация. В таких случаях прогноз практически всегда неблагоприятен. Если говорить о нашей диагностике, она, как правило, запаздывает.
Большинство больных приходит к нам на третьей стадии заболевания (когда лимфоузлы уже поражены опухолевыми клетками). Это касается как рака пищевода, так и рака желудка. Это происходит потому, что в России нет государственных программ скрининга, которые позволяли бы выявлять ранние формы рака среди большого количества обследуемых. У нас же, пока не начнутся боли, никто не идет к врачам.
Если у человека возникают симптомы: боль, стеноз выходного отдела желудка, дисфагия, кровотечение из опухоли, это означает, что болезнь уже запущена и опухоль большая. Рак пищевода проявляет себя тогда, когда опухоль перекрывает просвет и человек не в состоянии проглатывать пищу. С вероятностью 95% можно говорить о том, что болезнь запущена и третья стадия как минимум. Однако бывает и вторая стадия — когда опухоль большая, но поражения лимфоузлов нет, но это происходит довольно редко. 60% больных приходят к нам уже на третьей стадии. Ранние формы рака можно выявить в тот момент, когда человека ничего не беспокоит.
Диагностика
ФГДС (фиброэзофагогастродуоденоскопия) — исследование, на которое нужно получить направление при любом желудочном дискомфорте. Именно ФГДС — первая ступень в диагностике рака желудка или пищевода после того, как выявлена принадлежность к группам риска. Опытный специалист не будет смотреть желудок не осмотрев пищевод. Пищевод смотрится как при вхождении, так и на «обратной дороге».
Когда нужно делать ФГДС?
При любых проявлениях желудочного дискомфорта или боли. Это относится абсолютно к любому возрасту, ждать сорока лет не нужно.
Как сделать ФГДС?
Вы приходите с определенной жалобой к терапевту и пожеланием выполнить ФГДС. Грамотный доктор не будет настаивать на том, чтобы была проведена просто тест-терапия, без визуального и морфологического подтверждения.
Как понять, что дискомфорт — желудочный?
Желудочный дискомфорт четко связан с приемом пищи. Это тяжесть в желудке, тощаковые боли. Если на ФГДС ничего не находится, значит проблема не с желудком, и следует сделать УЗИ.
Что делать, если мне отказывают или не сообщают о проведении биопсии?
Настаивать. Нужно понимать, что людей, которые делают эндоскопию профессионально, меньше, чем необходимо. Понять это, пока вы не придете в клинику, невозможно.
Биопсия при ФГДС — это больно?
Нет, слизистая оболочка желудка не имеет болевых рецепторов.
Если у меня гастрит, я вхожу в группу риска?
Гастрит с обсеменением helicobacter pylory входит в группу риска, также как и атрофический гастрит. Диагностировать это можно с помощью правильно выполненной гастроскопии. Необходимо делать во время ФГДС множественную биопсию, потому что диагноз «гастрит» ставится только на основании морфологического исследования. Если вам выполнили ФГДС, не взяв биопсию и сказали, что у вас гастрит — уходите от такого доктора. На приеме для этого необходимо просто спросить у эндоскописта, будет ли он делать вам биопсию. Множественная биопсия сейчас входит в официальные стандарты гастроэнтерологии. Кроме этого, нужно провести тест на обсеменение helicobacter pylory либо наиболее точный уразный тест. Вы дышите в трубочку, а прибор регистрирует уровень вырабатываемого бактерией фермента уразы.

Нужны ли особые условия для ФГДС?
Правильная ФГДС делается за 20 минут в несколько этапов, обязательными являются хромогастроскопия, биопсия, инверсия и осмотр в специальном спектре (например NBI). Необходимо использование красителя метиленового синего для окрашивания стенок. Именно с этим красителем можно выявить ранние формы заболевания. Через инструментальный канал эндоскопа при каждой ФГДС обязательно вводят краситель (хромогастроскопия). Также при проведении процедуры эндоскопист должен сделать инверсию — развернуть эндоскоп в сторону кардии. Также есть различные варианты другого спектра, когда рассматриваются слизистые, строение сосудистого рисунка.
Можно ли сделать анестезию при ФГДС?
Да, сейчас часто делают ФГДС в дневных стационарах поликлиник с использованием наркоза — седации. Человек спит, но аппарата искусственной вентиляции легких не требуется.
Стадирование заболевания и выживаемость
Прежде чем дать человеку прогноз, нам необходимо его правильно отстадировать. Во-первых, мы определяем степень прорастания опухоли в стенку органа, во-вторых, выясняем, есть ли поражение лимфоузлов, в-третьих — наличие отдаленных метастазов.
Первая стадия при раке желудка: 85% вероятности прожить 5 лет и более. Надо понимать, что 15% заболевших начнут прогрессировать и с первой стадией. 100% выживаемости нельзя достичь, несмотря на раннюю стадию. Вторая стадия — показатель пятилетней выживаемости от 55 до 60%. Третья стадия — 35-40%. То есть, почти 70% больных погибают при третьей стадии, не перешагнув пятилетний рубеж. Большинство из этих 70% на третьей стадии умирают в первые два года болезни.
Рак пищевода протекает, как правило, агрессивнее рака желудка. Самый распространенный вид рака для пищевода — плоскоклеточный. Он и наиболее агрессивный.Так, 80% с первой стадией переживут пятилетний рубеж. Из тех, кому диагностировали заболевание на второй стадии, при существующих видах лечения выживает только половина. Менее 20% при третьей стадии рака пищевода смогут пережить пятилетний рубеж. Самое важное, что пока опухоль не перекроет просвет, каких-либо симптомов и затруднений не будет.
Профилактика
Могу ли я исключить себя из группы риска заболеть раком желудка и раком пищевода?
В целом, да. Основная профилактика очень проста: нужно не курить, не употреблять спиртное, особенно крепкие напитки, а также избегать очень горячих жидкостей. Однако даже если убрать все факторы, никто не даст гарантии, что этих двух заболеваний удастся избежать.
Маршрутизация
Я боюсь заболеть раком желудка/пищевода. Иногда у меня есть неприятные ощущения. Что мне делать?
Вариант первый (опухоль не найдена). Цепочка терапевт — эндоскопист (ФГДС) — гастроэнтеролог — лечение. Прийти к терапевту, описать свои опасения и жалобы, взять направление на ФГДС. На приеме у эндоскописта получаете рекомендацию вернуться за результатами гистологического исследования (от 10 дней до трех недель). Результаты необходимо показать гастроэнтерологу. Гастроэнтеролог проводит лечение в случае, если оно требуется.
Вариант второй (опухоль есть). Цепочка терапевт — эндоскопист (по направлению) — гистологическое исследование (две недели в среднем) — онкологическая поликлиника (стадирование рака) — КТ, УЗИ, колоноскопия (по направлению, около трех недель) — онкодиспансер (запись на две недели вперед).
Вы получили направление на эндоскопию. Эндоскопист подозревает по явным признакам, что рак есть. Его задача — взять информативную биопсию из разных участков пораженной слизистой и отправить гистологию в нормальную лабораторию. Очень много зависит от того, как качественно сделают гистологическое исследование. После того, как диагноз «рак» подтверждается в лаборатории, необходимо идти в онкологическую поликлинику. Там заболевание должны адекватно стадировать, проведя ряд диагностических тестов. Обязательно назначаются компьютерная томография грудной клетки и брюшной полости (ожидание 1-1,5 месяца), УЗИ малого таза, обязательным исследованием также является колоноскопия. Дело в том, что у 5% больных на фоне рака желудка может быть рак кишечника (колоректальный рак). Как только на руках есть все данные, можно идти к онкологу в онкодиспансер или в федеральный центр. На основании этих данных определяется дальнейшая тактика лечения. На комиссии решается, какое лечение пациенту необходимо и куда его необходимо госпитализировать.
От похода к терапевту до получения всех результатов, проводимых по ОМС, проходит в среднем около двух месяцев. Нужно понимать, что эти два месяца на течение опухоли не повлияют.
По новому приказу Минздрава мы не можем проводить этап диагностики дольше 30 дней. Это абсолютно утопическая цифра. Во-первых, большой поток людей. Во-вторых, нехватка грамотных специалистов — тех же морфологов, чтобы был поставлен диагноз. Так что ожидание результатов гистологического исследования длиной в две-три недели — это, увы, реальный срок.
Проблем много. Иногда люди приходят после всех тестов в онкодиспансер, его результаты пересматривают, но процентах в тридцати исследования на дисках оказываются неинформативными. Может быть недостаточно контраста, или его вообще нет. Почему это происходит — объяснить сложно. Нюансов много, и срыв может произойти на любом этапе. Иногда он бывает и счастливым — при повторном исследовании оказывается, что рака нет, но это бывает редко.
Лечение
Основным методом лечения для рака желудка является хирургический. Это удаление больного органа, лимфодиссекция — удаление лимфоколлекторов вокруг желудка (области, которая потенциально обладает метастазами). Удаление лимфоузлов — диагностическая процедура, позволяющая дополнительно уточнить стадию заболевания. Для этого необходимо изучить не менее 22 лимфоузлов. Отсутствие метастазов в лимфоузлах — благоприятная ситуация, означает вторую стадию и увеличенные шансы для больного.
Есть ли варианты операции через небольшие разрезы?
Да, есть. Малоинвазивные вмешательства возможны при ранних формах рака. Когда опухоль находится в пределах слизистой оболочки желудка, можно даже оставить орган полностью, оперировав его эндоскопически (эндоскопическая диссекция в подслизистом слое). Удаляется пораженный участок слизистой при отступлением от края опухоли. Если операция проходит успешно и по данным морфологического исследования, опухоль действительно не проросла сквозь слизистую, то больному больше не требуется дополнительного лечения. Однако не каждый онкоцентр обладает возможностями таких высокотехнологичных операций. Они делаются за счет федеральной квоты по показаниям.
Если рак проник сквозь слизистую оболочку и прорастет в подслизистый слой, и объем опухоли небольшой, есть возможность сделать лапароскопию. Всего делается пять небольших разрезов и пятисантиметровый небольшой разрез над пупком, чтобы «вытащить» удаленный материал.

Когда делают химиотерапию?
Химиотерапия, как правило, используется на четвертой стадии либо на третьей стадии — для борьбы с отдаленными метастазами или уменьшения вероятности прогрессирования опухоли.
Куда проникают метастазы при раке желудка?
Метастазирование обычно происходит в печень, брюшину, параортальные лимфоузлы. При отдаленных метастазах оперировать желудок не следует. Прогноз для больного это не улучшит, а качество жизни ухудшит катастрофически.
Всегда ли удаляют желудок полностью?
Если опухоль расположена на границе желудка с двенадцатиперстной кишкой, если есть возможность отступить от края опухоли необходимое расстояние, то можно сохранить желудок частично. Однако объем лимфоаденэктомии остается прежним.
В каких случаях делается химиотерапия перед операцией?
Если есть массивное поражение лимфоузлов или опухоль вышла за стенки желудка, идти на операцию сразу нельзя. Больному должны предложить вариант дооперационной (неоадъювантной) химиотерапии. При этом нужно понимать, что иногда даже ранние формы рака могут быть диссеминированными — распространенными по брюшине. Чтобы это понять при осмотре брюшной полости, делается смыв с брюшины, оправляется цитологу на исследование. Если находятся свободные опухолевые клетки, то человек попадает в ту же группу, что и пациенты с отдаленными метастазами. Эта группа пациентов вместе с обладателями продвинутых форм рака желудка рассматриваются как кандидаты для неоадъювантной формы химиотерапии.
Мне удалят желудок. Как я буду жить?
Во время операции кишку сшивают с пищеводом. Человек продолжает есть естественным путем, однако диета назначается пожизненная с заместительной ферментной терапией. Нужно чаще есть, однако качество жизни будет нормальным.
Есть ли смысл лечиться?
Если не удалить больной желудок, вероятность того, что вы переживет пятилетний рубеж — 5-7%. Если его удалить, то даже на третьей стадии пережить пятилетний рубеж можно с вероятностью 50%. В нормальных специализированных центрах частота осложнений на превышает 12-15%, а летальность после таких операций не превышает 2-3%. Так что, если лечиться, шансов выжить спустя пять лет в 10 раз больше, чем если прийти, развести руками и не делать ничего.
Эффективность лечения рака зависит не только от развития методов терапии — без постановки точного морфологического диагноза врач-онколог не может выбрать подходящий для конкретной опухоли вид лечения. Важным компонентом современной онкологической помощи, который, к сожалению, часто остается в тени достижений технологий разрушения опухолей, является правильная постановка диагноза. А точнее — определение типа опухолевых клеток и, соответственно, их устойчивости к различным видам внешнего воздействия. Решает эту задачу морфологическая диагностика, базовый принцип которой — исследование образцов опухолевых клеток.
С каким образцами опухолевых клеток работает патоморфология?
Базой для морфологической диагностики являются образцы тканей (фрагменты опухолей). Наиболее частым способом забора материала является трепан-биопсия, которая осуществляется при помощи специальной толстой иглы, также используется инцизионная биопсия, которая выполняется при помощи скальпеля и эксцизионная биопсия с тотальным забором пораженного участка (например, биопсия лимфоузла при диагностике лимфом).
После образцы тканей проходят этапы специальной подготовки (фиксации и проводки), после чего пропитываются парафином с формированием блока. Из блоков на специальных устройствах (микротомах) приготавливаются тонкие срезы толщиной 4-5 микрон. Полученные срезы помещаются на стекла, подвергающиеся различным методам окраски с целью выделения различий в клеточных структурах. Эти, так называемые, “стекла”, подлежат тщательному рассмотрению врачом-патоморфологом.
Каждый из этапов подготовки образцов критичен для возможности и точности последующих молекулярных методов исследования, поэтому нарушение технологии подготовки может привезти к неправильному назначению лечения.
Зачем изучать опухоли под микроскопом?
Количество известных разновидностей опухолей — велико. Наиболее полной считается классификация Всемирной организации здравоохранения (ВОЗ), которая в печатном виде представляет собой 11 томов, около 400 страниц в каждом. Итог — ошибки в постановке диагноза неизбежны.
Патоморфологическая классификация опухолей Всемирной организации здравоохранения (ВОЗ) едва уместилась в 11 томов
Показатель ошибок при постановке диагноза поражает: от 5 до 50% всех онкологических диагнозов в мире — неверны. Половина этих ошибок не становятся фатальными — различные виды рака могут одинаково реагировать на определенный подход к лечению. Но значительная часть неточностей приводит к неадекватному лечению рака у пациентов, которое может способствовать прогрессированию заболевания.
Среди объективных причин ошибочных диагнозов, связанных с морфологической диагностикой, лидирует невозможность получения образца опухолевой ткани для ее морфологического исследования ввиду трудности доступа либо тяжелого состояния пациента.
Среди субъективных причин ошибок морфологической диагностики наиболее распространены:
- ошибка при заборе материала (например, при раке простаты следует проводить множественный забор образцов, т.к. опухоль в этом органе может иметь крайне сложную пространственную форму);
- отсутствие возможности конкретного лечебного учреждения провести морфологическую диагностику в необходимом объеме (собственная морфологическая лаборатория — это сложный и дорогой институт);
- нарушения протоколов как в части отказа от забора и морфологического исследования образцов, так и в части стандартов проведения морфологической диагностики опухоли (в том числе и устаревшие методики, отсутствие необходимого оборудования, низкая квалификация специалистов, на повышение которой не выделяется средств).
И только морфологическая диагностика, проведенная с соблюдением всех стандартов взятия материала, подготовки и рассмотрения образцов, способна дать окончательный ответ о типе опухоли и ее особенностях.
Гистология и иммуногистохимия — в чем отличие?
Первоначально, морфологическая диагностика решала задачу определения наличия злокачественного процесса в ткани. Для этого применялся метод, который в современной медицине называется “гистологическое морфологическое исследование”, или, как часто можно услышать от пациентов “гистология”.
С помощью гистологического морфологического исследования может быть проведена дифференциальная диагностика доброкачественных процессов и злокачественной опухоли — т.е. определение наличия измененных (атипичных) клеток в образце тканей. Простое гистологическое исследование в любом случае носит субъективный характер и зависит от профессионализма проводящего его врача. Поэтому, при подозрении на наличие опухоли, второе мнение от ведущих экспертов МИБС в этой области значительно снижает риск ошибочного диагноза.
При подтверждении опухолевого процесса в тканях, пациенту требуется более точная диагностика, которая точно определит тип опухоли и укажет на наиболее эффективный подход к ее лечению — иммуногистохимия.
Зачем нужно иммуногистохимическое исследование?
Основой иммуногистохимии является окрашивание клеток специфическими веществами, которые реагируют на определенные типы опухолевых клеток и “мишени”, специфические свойства и мутации генов конкретного типа рака.
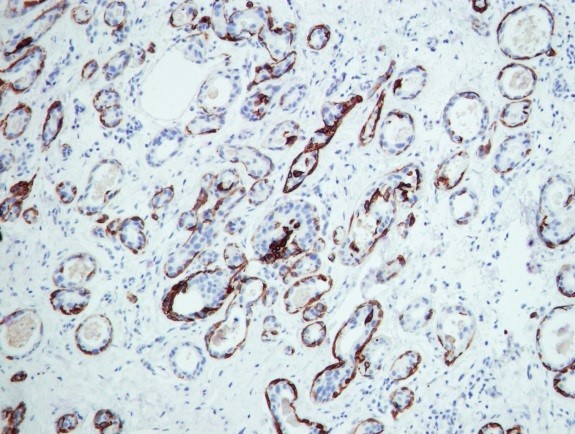
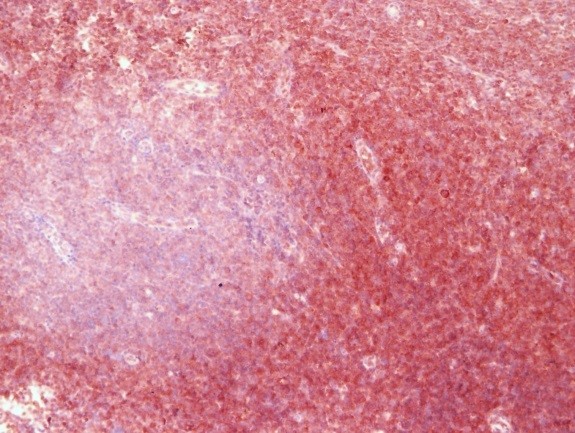
Пример иммуногистохимии в МИБС: Позитивная реакция на СК14 (коричневое окрашивание) вокруг всех подозрительных структур исключает рак молочной железы – дополнительное лечение пациентке не требуется
Таким образом, иммуногистохимия позволяет точно указать нозологию (разновидность) опухоли, что чрезвычайно важно для проведения адекватного лечения, а также – для прогнозирования развития заболевания. Например, некоторые разновидности рака молочной железы (тубулярный, фиброматоз-подобный) не требуют иного лечения, кроме хирургического.
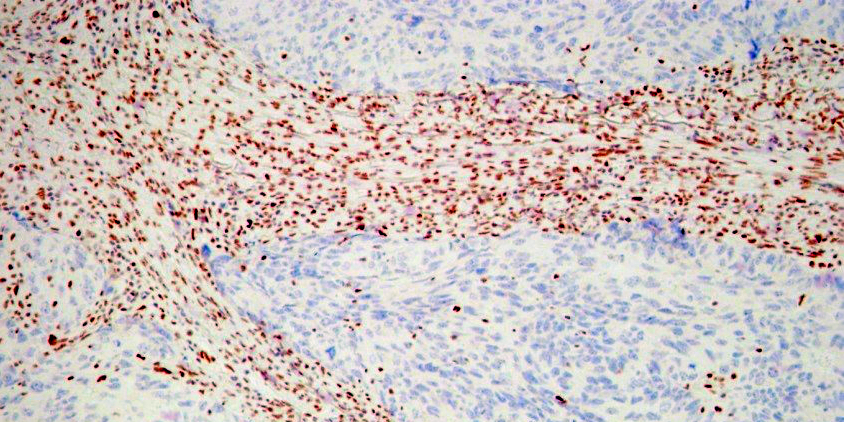
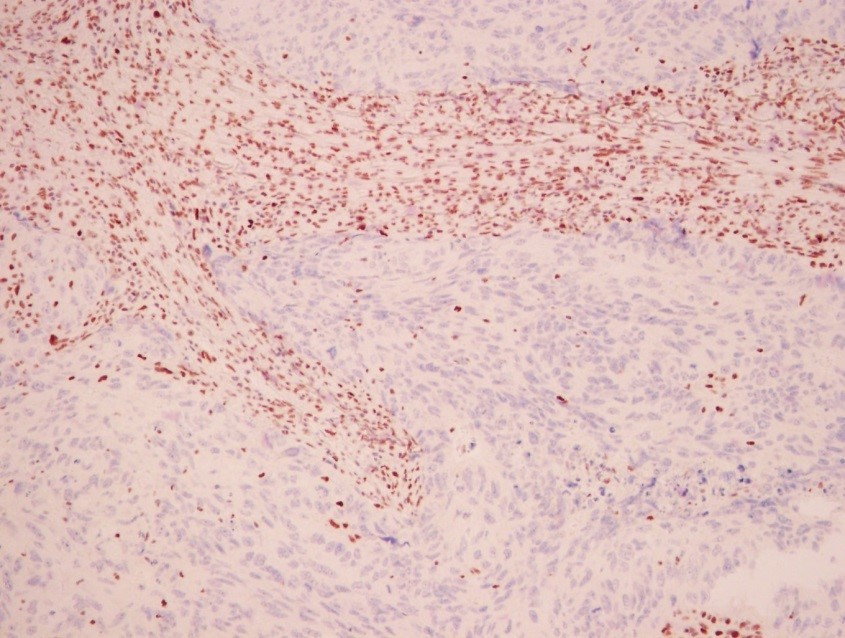
Иммуногистохимия в МИБС: Позитивная реакция на bcl10 в лимфоидных клетках конъюнктивы глаза (коричневое окрашивание вокруг фолликула) подтверждает диагноз MALT-лимфомы, при которой наибольшего эффекта покажет химиотерапия, а не хирургическое лечение
Лечим метастазы. Когда не обойтись без патоморфолога?
Метастазы представляют собой “копию” злокачественных клеток первичной опухоли, точнее, того типа тканей, из которых развилось новообразование. Поэтому тип клеток метастаза может указать на локализацию первичного рака. Это крайне важно, если первичная опухоль не проявляет себя симптомами и не диагностирована. С другой стороны, если первичная опухоль, имеет уязвимость к препаратам таргетной терапии, то ее метастазы могут утратить это свойство. В таком случае иммуногистохимия образца метастазов покажет, что для первичной опухоли лечение будет прежним, а вот для метастазов следует избрать другой подход.
Молекулярные исследования + Таргетная терапия + Иммунотерапия = Эффективное лечение рака
Благодаря развитию методов молекулярной диагностики (иммуногистохимия, ПЦР, секвенирование), лекарственная терапия рака идет большими шагами вперед. Помимо химиотерапии, сейчас активно используются таргетные препараты, целенаправленно воздействующие на мишени в опухолевых клетках (HER2, CD20, c-kit, мутантный b-Raf и др.).
Кроме того, в настоящее время онкология переживает «бум» иммунотерапии, при применении которой лекарственные препараты разрывают порочный механизм, препятствующий уничтожению опухолей собственными иммунными клетками.
Однако для правильного назначения таких препаратов необходимым условием является определение специфических маркеров при помощи иммуногистохимического или молекулярно-генетического исследования опухолевой ткани. Более того, часто маркеры, указывающие на чувствительность к иммунотерапии (MMR, MSI), также говорят о том, что пациенту не следует назначать химиотерапию, в особенности это касается рака толстой кишки и желудка.
Иммуногистохимия показала, что негативная реакция на MSH2 (синее окрашивание ядер опухоли, коричневое окрашивание неопухолевой ткани) свидетельствует о том, что рак тела матки, представленный на данном слайде, чувствителен к иммунотерапии
Какой рак можно вылечить без операции?
Некоторые разновидности опухоли не только не требуют хирургического лечения, но оно им противопоказано, так как может привести к прогрессированию заболевания. Это прежде всего лимфома, опухоль, возникающая из лимфоцитов, которые располагаются как в лимфоузлах, так и в паренхиматозных органах.
Развитие иммуногистохимии и основанных на ее результатах таргетной терапии и иммунотерапии постоянно расширяют спектр видов рака, которые можно вылечить “точечным” воздействием исключительно на опухолевые клетки. Помимо лечения лимфомы, по состоянию на начало 2019 года наибольшее применение методы иммунотерапии и таргетного лечения получили при лечении таких заболеваний, как:
- рак молочной железы;
- рак простаты;
- рак кишечника;
- рак легкого;
- лимфомы;
- рак желудка;
- меланома
при которых современные протоколы лечения требуют выполнение иммуногистохимии. Большинство ошибок в диагностике и лечении данных заболеваний связано либо с не проведением иммуногистохимии, либо с ее неправильной интерпретацией. Цена ошибки, к сожалению, может быть фатальной, так как назначение неправильного лечения может привести к резистентности (устойчивости) опухолевых клеток к лекарственным препаратам, которые при правильном назначении часто приводят к выздоровлению пациента.
Как повысить качество морфологической диагностики в клиниках России?
Выбирайте МИБС как для первого проведения базовой морфологической диагностики либо иммуногистохимического исследования, так и для получения второго мнения от ведущих специалистов нашей медицинской компании относительно имеющихся образцов ткани опухоли (часто называемого пациентами “пересмотр стёкол”), полученных при обследовании в другом онкоцентре.
Почему следует выбрать патоморфологическую лабораторию МИБС?
- исследование и оценка рассматриваемого материала проводится одновременно несколькими ведущими специалистами в центральной патоморфологической лаборатории МИБС в Санкт-Петербурге, сотрудничающей с федеральными онкологическими центрами.
- все вопросы логистики центр МИБС в вашем регионе берет на себя.
- МИБС владеет всеми технологиями, необходимыми для постановки правильного патоморфологического диагноза. От вас не потребуется проводить дополнительные исследования в других лабораториях.
- Иммуногистохимическое исследование может быть проведено в полном объеме за счет средств ОМС (бесплатно для пациента) при наличии направления по форме 14у.
Как заказать морфологическое / иммуногистохимическое исследование в МИБС?
- позвоните в любой центр МИБС в вашем регионе;
- привезите материал (гистологические препараты, парафиновые блоки, копию выписки из истории болезни и прочие документы, описывающие характер заболевания) в центр МИБС вашего города;
- получите заключение через 3-10 дней (в зависимости от вида и объема исследования).
заместитель главного врача по лабораторной медицине МИБС
врач-патологоанатом
доктор медицинских наук
Рак желудка представляет собой один из самых распространенных видов онкологических заболеваний. Эффективное, информативное и точное средство диагностики этого и ряда других заболеваний – гистологическое исследование тканей желудка. Гистологический анализ подразумевает взятие образцов тканей желудка посредством биопсии и их микроскопическое исследование. Эта процедура дает врачу возможность поставить точный диагноз и назначить оптимальное лечение. Прежде всего, биопсия тканей желудка и их гистологическое исследование обязательно производится, если врач подозревает у пациента опухоль. Гистологический анализ предоставляет информацию о типе новообразования, клеточном составе опухоли. Если расшифровка результатов гистологии желудка дает положительный результат (наличие злокачественной опухоли), он расценивается как окончательный диагноз. Важно понимать, что плохой анализ гистологии – еще не приговор, так как многие виды опухолей, обнаруженные своевременно, успешно излечиваются. Если же результат отрицательный, нельзя исключать ошибку, виной которой может быть несовпадение местонахождения раковых клеток и места взятия биоптата. Если результат гистологического исследования отрицательный, однако симптомы опухолевого процесса присутствуют, процедура повторяется.
Показания для проведения гистологического исследования
— гипоацидный гастрит (это заболевание желудка считается предраковым);
— диагностика особых форм гастрита (гранулематозный, эозинофильный, лимфоцитарный гастрит);
— хроническая язвенная болезнь;
— дисфагия;
— пищевод Барретта;
— снижение веса, отсутствие аппетита, малокровие;
— стабильный дискомфорт в желудке, отвращение к мясной пище и другие.
Как подготовиться к эндоскопическому исследованию
— Лучшее время для проведения биопсии с последующим гистологическим анализом – утро. Исследование должно проводиться натощак, накануне вечером допустим лишь легкий ужин, исключается употребление жареной, жирной пищи.
— Необходимо прекратить принимать препараты, в которых содержится активированный уголь, железо.
— Накануне гистологического исследования исключаются жевательные резинки, курение. Мнительным пациентам показан прием успокоительных препаратов за день до процедуры.
Процедура забора биоптата
Биопсия забирается в ходе эндоскопического исследования. При этом врач вводит через рот и пищевод в желудок эндоскоп, который снабжен камерой и небольшими щипцами. При помощи камеры врач определяет подозрительные места на слизистой желудка, из которых необходимо взять биопсию. Затем подводит эндоскоп к данным дефектам, и при помощи щипцов откусывает небольшие кусочки. Поскольку в ходе биопсии отрываются небольшие кусочки, данная процедура практически безболезненная. После забора всех необходимых кусочков эндоскоп выводится наружу. Кусочки обрабатываются, как гистологические препараты, а затем врач-патологоанатом изучает их под микроскопом, выявляя наличие или отсутствие атипических (раковых) клеток. Иногда даже опытные специалисты не в состоянии взять кусочки из всех частей язвы. В этом случае необходимо провести биопсию повторно через некоторое время. Правильная биопсия является множественной, то есть врач забирает несколько кусочков для исследования из краев и дна каждого язвенного дефекта. Кроме того, забирается несколько кусочков из каждого рубца, видимого на месте зажившей язвы. Также рекомендуется забирать по нескольку кусочков биопсии из каждого подозрительного места на слизистой оболочке желудка. В настоящее время доказано, что 100%-я точность диагностики рака достигается забором не менее 6 кусочков из разных частей каждого язвенного и рубцового дефекта. Исследование только 1 – 2 кусочков является неинформативным, поскольку позволяет обнаружить рак на ранних стадиях только в половине случаев.
Стоимость и срок исследования
| Наименование | Срок | Стоимость, руб. |
|---|---|---|
| Гистологическое исследование биопсийного материала | от 3 дней | 5000* |
| Гистологическое исследование операционного материала | от 3 дней | 19500* |
* Организация и оплата доставки сырого материала (не в блоках) осуществляется клиентом.
По всем возникшим вопросам Вы можете проконсультироваться у нашего медицинского администратора по телефону: 8-800-555-92-67 или написать нам в WhatsApp: +7 925 740 05 87