Как часто женщине нужно проверяться на рак груди?
Здесь нет однозначного ответа. Никто точно не скажет, как часто молодой здоровой женщине до 40 лет нужно ходить к врачу. Когда врач сидит на 10-минутном приеме, ему легче сказать: «Приходите раз в год. Все, до свидания, следующий, заходите». У меня прием длится полчаса, и я специально оставляю хотя бы пять минут в конце, чтобы объяснить, что нет универсальных рекомендаций. Нужно уделять внимание своей груди, осматривать ее, но как часто это делать — тоже никто не знает. Самообследование не приводит к снижению смертности от болезни, но при этом каждую четвертую опухоль женщины находят сами. На сегодня мы еще не изобрели таких диагностических методов, которые нам до биопсии скажут: с грудью все ок или не ок.
После 40 лет все более-менее понятно: с этого возраста риск заболеть раком молочной железы достоверно увеличивается. Одни медицинские организации говорят, что скрининг (Обследование здоровых людей с целью выявить у них заболевание, которое пока никак себя не проявляет. — Прим. ред.) пора делать с 40 лет, другие — с 45 лет. Частота обследований тоже отличается. Рекомендации немного расходятся в зависимости от системы здравоохранения. В Америке есть как минимум две организации, которые занимаются разработкой программы скрининга: Рабочая группа по профилактике заболеваний (USPSTF) и Американское онкологическое общество. У них разные рекомендации, потому что в некоторых штатах преобладает афроамериканское население, которое болеет тяжелее. В Великобритании проверяют с 50 лет раз в три года.
Сам скрининг проводят до 75 лет, это связано с продолжительностью жизни. Нет смысла проводить скрининговое обследование, если ожидаемая продолжительность жизни менее 10 лет. Потому что, скорее всего, то, что мы обнаружим, не сократит жизнь этого человека, а медицинской системе обойдется дорого.
В России насчет скринингов все говорят разное. Например, некоторые гинекологи считают, что после 40 лет маммографию нужно делать ежегодно или хотя бы раз в два года, а после 50 лет — ежегодно. Но на самом деле мы не знаем, как часто нужно проходить маммографию. Поэтому пропагандировать, что это надо делать раз в год, без объяснения того, что это за исследование и что делать с его результатами, — неправильно.
И каждый раз думаю: боже, сколько неправильных действий могут повлечь за собой какие-либо рекомендации. Из-за этого я завела свой блог. Мне кажется, что основная проблема не в том, делаем мы маммографию или не делаем, а в том, что мы не общаемся с пациентами. У меня много пациенток, которые приходят с болью или находят у себя уплотнение, и тогда мы с ними прицельно разбираемся, что боль в молочной железе — это не спутник онкологического заболевания, что уплотнение — это просто локальный фиброаденоматоз, так ведет себя железистая ткань. Мы можем сходить с пациенткой на УЗИ и уточнить это или понаблюдать динамику.
Рекомендации — это такая штука, которая нас может поддержать. Но принимаем решение мы сами: врач и пациент. У меня была молодая пациентка, которая прошла химиотерапию, операцию и была вынуждена принимать препарат, вызывающий искусственную менопаузу. В какой-то момент она сказала, что больше не может, мы обсудили все риски и приняли решение отказаться от лекарства, тем самым повысив вероятность рецидива. Но это было общее решение. Без желания пациента его лечить никто не будет.
Кому-то дают странную рекомендацию ходить каждые полгода на УЗИ. Вот пациентка ходит, делает очередное УЗИ, ей говорят, что все нормально, проходит два месяца, и она приходит ко мне с шишкой. А там рак. И она сидит в слезах на приеме: «Я ходила каждые полгода, потому что мне так сказали». Скрининг направлен на то, чтобы поймать рак, когда еще нет симптомов. Но не всех можно поймать.
Есть такая фраза, что мы скринингом пытаемся поймать «орлов» и «зайцев» — это быстрые, стремительные, очень внезапные раки, а ловим «черепашек», потому что они ползут-ползут и вот в какой-то момент мы находим их на маммографии.
«Черепашек» нужно лечить или можно их не трогать?
«Черепашки» — это не камни, которые не двигаются. Они все равно прогрессируют. Мы никогда не узнаем, как они себя поведут, потому что неэтично не лечить рак. Нет критериев, которые бы сказали, можно злокачественную опухоль наблюдать или ее нужно сразу же лечить. Вот есть карцинома in situ, это неинвазивный рак. После того, как его обнаружили, у женщины в восемь раз увеличивается риск инвазивного рака.
Инвазивный рак — один из основных раков молочной железы, это порядка 70% случаев. Пока опухоль внутри молочного протока — это нулевая стадия рака, он не может метастазировать. Инвазивный рак — это уже опухоль, которая вышла за пределы протока и у нее появляется шанс дать метастазы. И вот, казалось бы, что карциномы in situ можно наблюдать без вмешательства, но нет, потому что они могут развиваться в инвазивную опухоль.
А вот дольковая карцинома in situ не является злокачественной опухолью. Это стало понятно совсем недавно — в 2017 году, до этого к ней относились так же, как к внутрипротоковой карциноме. А теперь стало понятно, что она доброкачественная и ее не нужно оперировать. На сегодня нет таких форм рака молочной железы, которые этично наблюдать, в отличие например от некоторых видов рака предстательной железы.
Как врач определяет, рак перед ним или не рак?
В тот момент, когда мы ловим что-то в груди, мы не знаем, что это. Это кот в мешке. Биопсия все решает, и без нее лечение от рака никто не начнет. Даже пункция (Подвид биопсии, когда берут взвесь клеток, а не кусочек ткани. — Прим. ред.) не является основанием для лечения.
Решение о том, проводить биопсию или нет, принимают согласно критериям BI-RADS — Breast Imaging Reporting and Data System. Это шкала от нуля до шести, по которой рентгенолог ставит балл на основании маммографии, УЗИ или МРТ. BI-RADS 0 означает, что нужен дополнительный анализ, BI-RADS 2 — что опухоль доброкачественная, BI-RADS 4 — что есть подозрение на рак. С этим результатом пациентка приходит к онкологу или клиническому рентгенологу, и он принимает решение, делать биопсию или нет.
Рентгенолог может поставить BI-RADS 3. Это меньше 2% вероятности того, что есть рак молочной железы. Если BI-RADS больше, то нужно будет принять решение о биопсии, но образование совершенно не обязательно окажется раком. На биопсии рак уже нельзя перепутать с чем-то. Если это опухоль, это опухоль.
Если посмотреть на графики заболеваемости раком груди и смертности от него в России, видно, что заболеваемость растет, а смертность нет. Как это можно объяснить, по-вашему?
Это реально так. Проблема в том, что мы не можем понять достоверно: это потому, что мы делаем скрининг и лечим лучше, чем раньше, или только потому, что просто лечим лучше? Прерывать то или другое для того, чтобы выяснить причину, — неэтично, потому что от рака умирают.
Основной плюс маммографии не только в том, чтобы держать смертность под контролем. Маммография сильно влияет на объем лечения. Когда мы обнаруживаем опухоль на первой стадии, без симптомов, у нас есть возможность пролечить минимально: прооперировать и назначить профилактические таблетки. Когда этот же рак доходит до стадии клинических симптомов, мы уже не можем только этим обойтись. Тогда мы должны прооперировать еще подмышку, что увеличивает риски лимфатического отека, провести химиотерапию, которая снижает качество жизни, и так далее.
Может ли врач пропустить рак?
Конечно, это огромная проблема. В трети случаев рак может быть не найден при маммографии. Есть, во-первых, рентгенонегативные раки, которые на рентгене не видны. Именно поэтому очень важно сначала осмотреть пациента, а потом назначать исследования. А то может прийти 45-летняя женщина на маммографию, и ей напишут по результатам снимка: все ок. И она думает: ага, значит, эта шишечка — ничего страшного.
Да, бывает, что доктор ошибается, считает, что в анализах нет ничего страшного и не надо делать биопсию, или получает неинформативную биопсию и назначает какую-нибудь травку, просто чтобы пациента не оставлять без наблюдения. Хорошо, если пациент придет на следующее обследование пораньше.
А может врач, наоборот, перестраховаться там, где не надо?
У меня сейчас наблюдается пациентка. Что-то ее забеспокоило, закололо, и она пришла. Ей сделали маммографию, рентгенолог написал, что все нормально, а я вижу на снимке скопление кальцинатов (солей кальция) и тень в этом месте. То есть то ли он не видел, то ли он просто копипаст сделал, не понятно. И вот здесь начинаются минусы гипердиагностики.
Я говорю: «Вы знаете, тут что-то подозрительное, надо идти и делать не скрининговую маммографию, а прицельную, на которой сомнительное место фотографируют при увеличении». Естественно, пациентка волнуется. Она записывается на процедуру, ждет. По результатам снимка ей пишут BI-RADS 4, то есть нужно делать биопсию. Я тоже нервничаю, потому что недавно в том же самом месте писали, что все нормально, BI-RADS 2, а теперь когда я отправила эту пациентку досмотреть, пишут 4.
Потом мы идем на УЗИ, там ничего нет. Она записывается на МРТ — опять ожидание, ведь МРТ делают в определенный день цикла, а он у нее скачет. Она получает результат МРТ, там все нормально, но я прошу коллегу пересмотреть.
Мультимодальных диагностов молочной железы, которые владеют всеми методами диагностики, у нас в стране немного. Мне говорят: «Тут ничего нет, это нормальные кальцинаты, не подозрительные. Понятно, почему они тебя заинтересовали, но на прицельном снимке все ок». Я отвечаю: «Но рентгенологи BI-RADS 4 ставят, что они там видят-то?» Пациентка все это время была как на пороховой бочке.
Вот что происходит из-за гипердиагностики. Биопсию ей мы делать не стали. Но через полгода все нужно повторять, потому что я не могу отпустить ее на два года до следующего осмотра.
Это проблема интерпретации снимков?
Да, это проблема чтения снимков. Не знаю, может, я запустила эту волну и коллеги напугались, может, смотрел кто-то не совсем опытный. Проблема в том, что у нас нет метода диагностики до биопсии, который отвечает на вопрос: да-да, нет-нет.
В скандинавских странах одна из образцовых систем скрининга: там сидят два опытных рентгенолога и отсматривают снимки. Если их мнение совпадает, пациентке выдают диагноз. А если у них мнение не совпадает, то с ними проводят работу над ошибками. А у нас на скрининге, наоборот, сидят люди, которые вчера выпустились, потому что опытным интереснее где-нибудь еще.
Маммограмму еще нужно качественно отснять. Даже с прицельной маммограммой можно ошибиться. Но, каким бы ни было качество снимка, если человек не умеет интерпретировать, у него недостаточно опыта или он перестраховывается — от ошибок не уйти.
Еще надо понимать, что у одного доктора может быть этих маммограмм тридцать штук за день. Это же нереально. Человек может принять до семи, максимум девяти взвешенных решений, если он себя круто прокачал. А у нас люди продолжают сидеть, принимать по тридцать человек и отсматривать по тридцать снимков.
Какие еще есть минусы у гипердиагностики помимо лишних обследований и волнений?
Человек может проходить ненужную биопсию, ведь кто-то сделал бы биопсию в случае с моей пациенткой, о котором я рассказывала выше. Рентгенолог же поставил BI-RADS 4. Каждый рентгенолог может ошибиться, не только неграмотный или тот, который перестраховался.
Бывают более неоднозначные случаи. У меня была пациентка из государственной поликлиники, которая пришла с заключением BI-RADS 4 с обеих сторон груди. Я смотрю ее на УЗИ — там ничего. Смотрю маммограмму — ну да, есть скопление кальцинатов, но даже я вижу, что ничего страшного, хотя я не рентгенолог.
Ей вполне могли сделать биопсию, лечить бы не лечили, но понервничать заставили. Гипердиагностика неприятна именно из-за ненужных процедур, ненужных биопсий и больших переживаний по этому поводу.
Еще есть проблема в том, что в некоторых клиниках просто так назначают обследования. До «Чайки» я работала в клинике, где после каждого пациента меня вызывали на ковер и спрашивали: «Почему вы не назначили пациентке анализ крови, мочи, кала, где УЗИ?» Я говорю: «Без симптомов УЗИ делать не надо». А они ссылаются на рекомендации акушеров-гинекологов, на внутренние протоколы, которых никто никогда не видел. Онкомаркеры — это вообще любимейшая тема. «Почему вы ей не назначили онкомаркеры?» — говорят. Потому что их никому не надо назначать.
Так что я представляю себе этот кошмар, с которым пациентки могут встретиться. Поэтому лучше идти в клинику и к врачу, которому доверяешь
Взятие биологического материала и его тщательный гистологический анализ очень значимы во многих отраслях медицины. С целью выявления патологии может назначаться, например, гистология родинки, шейки матки, органов пищеварительного тракта, эндокринной системы и так далее. На наши вопросы о гистологии ответил врач — онколог-маммолог «Клиники Эксперт» Воронеж Сергей Викторович Ежов.
— Сергей Викторович, расскажите, что это за анализ — гистология? В чём его суть?
— Гистологический анализ — это высокоточный метод исследования, позволяющий определить патологическое отклонение в строении ткани. Данный метод используется во многих областях медицины, но его основная суть заключается в том, что с помощью этого метода можно диагностировать наличие злокачественных образований, определить их структуру, а также стадию патологического процесса.
— Что может являться биоматериалом для гистологического исследования?
— Биоматериалом может служить та или иная подозрительная ткань (кожа, слизистая оболочка, мышца, кость), взятая при помощи биопсии, либо препарат, полученный в результате хирургического вмешательства.
— Когда назначается гистология?
— Как я уже говорил, гистологическое исследование может применяться во многих направлениях медицины, но особенная его ценность заключается в определении природы и характера изменений в ткани при малейшем подозрении на онкологический процесс. Также это исследование проводят перед назначением противоопухолевой терапии для разработки плана лечения и во время лечения с целью контроля его эффективности.
— Что показывает гистология?
— Гистологический анализ даёт возможность обнаружить воспалительные процессы в ткани, установить природу того или иного новообразования (т. е. доброкачественное оно или злокачественное), определить уровень злокачественности, а также выявить локализацию первичного опухолевого очага. Надо понимать, что расшифровкой результатов гистологического исследования должен заниматься только специалист. Я бы не рекомендовал пациентам делать это самостоятельно.
Взятие биологического материала и его тщательный гистологический анализ очень значимы во многих отраслях медицины. С целью выявления патологии может назначаться, например, гистология родинки, шейки матки, органов пищеварительного тракта, эндокринной системы и так далее. На наши вопросы о гистологии ответил врач — онколог-маммолог «Клиники Эксперт» Воронеж Сергей Викторович Ежов.
— Сергей Викторович, расскажите, что это за анализ — гистология? В чём его суть?
— Гистологический анализ — это высокоточный метод исследования, позволяющий определить патологическое отклонение в строении ткани. Данный метод используется во многих областях медицины, но его основная суть заключается в том, что с помощью этого метода можно диагностировать наличие злокачественных образований, определить их структуру, а также стадию патологического процесса.
— Что может являться биоматериалом для гистологического исследования?
— Биоматериалом может служить та или иная подозрительная ткань (кожа, слизистая оболочка, мышца, кость), взятая при помощи биопсии, либо препарат, полученный в результате хирургического вмешательства.
— Когда назначается гистология?
— Как я уже говорил, гистологическое исследование может применяться во многих направлениях медицины, но особенная его ценность заключается в определении природы и характера изменений в ткани при малейшем подозрении на онкологический процесс. Также это исследование проводят перед назначением противоопухолевой терапии для разработки плана лечения и во время лечения с целью контроля его эффективности.
— Что показывает гистология?
— Гистологический анализ даёт возможность обнаружить воспалительные процессы в ткани, установить природу того или иного новообразования (т. е. доброкачественное оно или злокачественное), определить уровень злокачественности, а также выявить локализацию первичного опухолевого очага. Надо понимать, что расшифровкой результатов гистологического исследования должен заниматься только специалист. Я бы не рекомендовал пациентам делать это самостоятельно.
Биопсия
— Как сдать анализ на гистологию? Нужна ли специальная подготовка?
— Перед тем, как провести гистологическое исследование, необходимо выполнить биопсию и отправить полученный при этом материал (биоптат) на анализ. Как таковой подготовки биопсия не требует, существует лишь ряд ограничений и рекомендаций, которых нужно придерживаться пациенту накануне и во время забора биоптата. Важно поставить врача в известность обо всех принимаемых препаратах. Накануне исследования необходимо отказаться от лекарственных средств, влияющих на свёртываемость крови (по согласованию с доктором, назначившим их), а также сообщить врачу, который будет выполнять биопсию, о наличии аллергии. Нежелательно проведение данной манипуляции у женщин в дни менструации. Противопоказано употребление алкоголя.
— Как проводится гистология?
— Полученный при биопсии материал помещается в формалин и направляется на гистологическое исследование в патоморфологический центр. Там материал заливается парафином (чаще всего). После остывания, отвердевания делаются тонкие срезы, на которые наносятся различные реактивы для детального изучения ткани под микроскопом врачом-патоморфологом.
— Сколько делается гистологический анализ?
— Если результат очевидный и не вызывает сомнений, выдача заключения производится в среднем через 7-10 дней. При возникающих сомнениях, подозрениях в точности поставленного диагноза препарат могут изучать дольше.
— Бывают ли ошибки в результатах гистологии?
— К сожалению, особенно в небольших населённых пунктах, могут возникать проблемы с качеством проведения гистологического анализа. Это связано с разными причинами (отсутствие врачей, оборудования, расходных материалов). Но в случае появления сомнений в правильности гистологического заключения обычно назначается пересмотр готовых препаратов в другом патоморфологическом центре.
Хотите больше узнать о других видах анализов? Читайте статьи в нашей рубрике
Записаться на приём к онкологу можно здесь
ВНИМАНИЕ: услуга доступна не во всех городах
Беседовала Марина Воловик
Редакция рекомендует:
Предрак: бояться или не обращать внимания?
У страха глаза велики. Так ли опасна миома?
Рак груди — не приговор!
Для справки:
Ежов Сергей Викторович
В 2007 году окончил лечебный факультет Курского государственного медицинского университета.
2007 — 2009 гг. — клиническая ординатура по специальности «Онкология» в Медицинском радиологическом научном центре РАМН г. Обнинск (сегодня — МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России).
В настоящее время — врач — онколог-маммолог в «Клинике Эксперт» Воронеж.
Приём ведёт по адресу: ул. Пушкинская, 11.
Пересмотр стекол
Москва,
Духовской переулок, 22Б
350015,
Краснодар,
Северная ул, 315
198035,
Санкт-Петербург,
Межевой канал, д.4, лит.А
603155,
Нижний Новгород,
Большая Печёрская ул., д.26
Обновлено: 06 июля 2022
61732
При онкологических заболеваниях материал опухоли берут для гистологического или цитологического исследования. Это необходимо для подтверждения диагноза и определения тактики дальнейшего ведения пациента.
Ежов Сергей Викторович
В 2007 году окончил лечебный факультет Курского государственного медицинского университета.
2007 — 2009 гг. — клиническая ординатура по специальности «Онкология» в Медицинском радиологическом научном центре РАМН г. Обнинск (сегодня — МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России).
В настоящее время — врач — онколог-маммолог в «Клинике Эксперт» Воронеж.
Приём ведёт по адресу: ул. Пушкинская, 11.
Пересмотр стекол
Москва,
Духовской переулок, 22Б
350015,
Краснодар,
Северная ул, 315
198035,
Санкт-Петербург,
Межевой канал, д.4, лит.А
603155,
Нижний Новгород,
Большая Печёрская ул., д.26
Обновлено: 06 июля 2022
61732
При онкологических заболеваниях материал опухоли берут для гистологического или цитологического исследования. Это необходимо для подтверждения диагноза и определения тактики дальнейшего ведения пациента.
Пересмотр гистологических стекол: опухолевая ткань
Полученный во время операции или на биопсии образец ткани (или клеточный материал) специальным образом фиксируют и окрашивают, чтобы изучить под микроскопом и иммуногистохимическими методами. Последние позволяют даже определить органопринадлежность опухоли. [1]
Что такое блоки и стекла?
Эти термины обозначают ткань, полученную во время биопсии и подготовленную особым образом. В первую очередь образцы заливают раствором формалина и проводят специальную обработку. Это нужно для того, чтобы зафиксировать материал, чтобы клетки не разрушились. Затем ткани необходимо придать нужную степень плотности. Для этого ее помещают в парафин – так получаются гистологические блоки.
Гистологические блоки, образец ткани помещен в парафин
Но и такие образцы пока еще не готовы к исследованию. Ткань в блоке нельзя рассмотреть под микроскопом, потому что она не пропускает свет, а слои клеток накладываются друг на друга. Чтобы ткань стала прозрачной и доступной для изучения, блок нужно нарезать на очень тонкие слои с помощью специального инструмента – микротома. Эти тоненькие слои помещают на стекла и фиксируют – получаются гистологические стёкла. [2,3]
Гистологические стекла
Если у пациента обнаружен рак, то лаборатория обязана хранить гистологические блоки пожизненно, а если патологии не выявлено – в течение пяти лет. Гистологические стекла при диагностированном онкологическом заболевании тоже хранятся пожизненно. Если нужно выполнить пересмотр, то можно обратиться в лабораторию, где проводилось исследование, и получить оба этих вида материала. [4]
Когда и почему необходим пересмотр стекол?
Если морфологическое заключение не соответствует клинической картине опухоли, а также снимкам МРТ или КТ, то стекла отправляют на пересмотр в другое лечебное учреждение. Обычно пересмотром стекол занимаются специалисты с многолетним стажем работы и уникальным опытом диагностики редких опухолей. Дополнительный ручной пересмотр исключает возможность ошибки, связанной с использованием автоматических анализаторов.
Почему могут возникать ошибки при первичном просматривании стекол?
- неправильный забор материала, например, захвачен не весь слой эпителия, и невозможно судить о глубине поражения;
- проведена биопсия участка здоровой ткани;
- некачественная обработка материала в лаборатории;
- малое количество изученных срезов;
- недостаточная квалификация патоморфолога. [5]
Качественное микроскопическое и иммуногистохимическое исследование позволяет начать оправданное и своевременное лечение опухоли, а значит, увеличивает шансы на излечение и выживаемость пациента при онкологических заболеваниях. Оптимально, если морфологический диагноз будет подтвержден двумя специалистами.
Список литературы:
- Tatyana S. Gurina; Lary Simms. Histology, Staining. Treasure Island (FL): StatPearls Publishing; 2021 Jan-.
- В. А. Корьяк, Л. А. Николаева. Основы гистологической техники. Учебное пособие.
- Гистологическое изучение микропрепаратов тканей и органов. Гистология, эмбриология, цитология. Под ред. д.м.н., доц. Н. Ю. Матвеевой. Владивосток, Медицина ДВ, 2015.
- Приказ МЗ РФ № 179н от 24.03.2016 г. «О правилах проведения патолого-анатомических исследований».
- P. Morelli, E. Porazzi, M. Ruspini, U. Restelli, and G. Banfi. Analysis of errors in histology by root cause analysis: a pilot study. J Prev Med Hyg. 2013 Jun; 54(2): 90–96.
Врач онколог, маммолог, хирург Алексей Галкин. Стаж 18+ лет. Принимает в Университетской клинике. Стоимость приема от 2000 руб.
Золотой стандарт для определения HER2 не установлен. Согласно ASCO/CAPs примерно 20% тестов HER2 могут быть неточными. К ним относятся преаналитические, аналитические и постаналитические переменные.
Причины неточностей анализа статуса HER2/neu
К таким преаналитическим переменным, которые влияют на производительность ИГХ или FISH относятся:
- время, необходимое для фиксации образца ткани;
- продолжительность его нахождения в растворе фиксатора;
- последующая обработка.
Такие переменные считаются менее значимыми при использовании методов гибридизации ISH, основанных на амплификации генов, и более значимыми для ИГХ, поскольку ДНК более стабильна, чем белок.
Время до фиксации, то есть время между биопсией или резекцией и помещением образца в фиксатор, должно быть как можно короче. Длительность фиксации оказывает большое влияние на результаты и является основным источником изменчивости. Для ИГХ предложен минимальный период фиксации 6-8 ч, руководящие принципы ASCO/CAP рекомендуют, чтобы фиксация не превышала 48 ч.
ИГХ обнаруживает сверхэкспрессию HER2 на уровне белка и зависит от условий проведения процедур тестирования. К ним относятся в дополнение к трем вышеперечисленным: денатурация, нагревание, извлечение антигена, используемая процедура окрашивания и интерпретация окрашивания. Несмотря на то, что существуют методы извлечения антигена, они могут привести к ложноположительным результатам иммуногистохимии.
Для определенного анализа нужно выбирать свой способ фиксации тканей.
Некоторые фиксаторы, химические вещества или тепло, могут помешать анализу FISH. Однако всегда применяется внутренний контроль для того, чтобы отличить отрицательный результат от неинформативного.
А например, иммуногистохимия способна ошибочно классифицировать опухоли на основе фиксированных формалином и внедренных в парафин образцов. А если использовать замороженный образец ткани того же пациента, то можно получить более точный результат. Фиксация формалином и парафиновое встраивание приводят к появлению множества артефактов, которые сбивают результаты анализа с толку. Очень трудно понять, получается действительно достоверный результат или ошибочный. Так утверждают многие специалисты. Результаты теста ИГХ наиболее надежны для свежих или замороженных образцов тканей. ИГХ является ненадежным способом тестирования тканей, которые сохраняются в воске или других химических веществах.
Врач онколог, маммолог, хирург Алексей Галкин. Стаж 18+ лет. Принимает в Университетской клинике. Стоимость приема от 2000 руб.
Золотой стандарт для определения HER2 не установлен. Согласно ASCO/CAPs примерно 20% тестов HER2 могут быть неточными. К ним относятся преаналитические, аналитические и постаналитические переменные.
Причины неточностей анализа статуса HER2/neu
К таким преаналитическим переменным, которые влияют на производительность ИГХ или FISH относятся:
- время, необходимое для фиксации образца ткани;
- продолжительность его нахождения в растворе фиксатора;
- последующая обработка.
Такие переменные считаются менее значимыми при использовании методов гибридизации ISH, основанных на амплификации генов, и более значимыми для ИГХ, поскольку ДНК более стабильна, чем белок.
Время до фиксации, то есть время между биопсией или резекцией и помещением образца в фиксатор, должно быть как можно короче. Длительность фиксации оказывает большое влияние на результаты и является основным источником изменчивости. Для ИГХ предложен минимальный период фиксации 6-8 ч, руководящие принципы ASCO/CAP рекомендуют, чтобы фиксация не превышала 48 ч.
ИГХ обнаруживает сверхэкспрессию HER2 на уровне белка и зависит от условий проведения процедур тестирования. К ним относятся в дополнение к трем вышеперечисленным: денатурация, нагревание, извлечение антигена, используемая процедура окрашивания и интерпретация окрашивания. Несмотря на то, что существуют методы извлечения антигена, они могут привести к ложноположительным результатам иммуногистохимии.
Для определенного анализа нужно выбирать свой способ фиксации тканей.
Некоторые фиксаторы, химические вещества или тепло, могут помешать анализу FISH. Однако всегда применяется внутренний контроль для того, чтобы отличить отрицательный результат от неинформативного.
А например, иммуногистохимия способна ошибочно классифицировать опухоли на основе фиксированных формалином и внедренных в парафин образцов. А если использовать замороженный образец ткани того же пациента, то можно получить более точный результат. Фиксация формалином и парафиновое встраивание приводят к появлению множества артефактов, которые сбивают результаты анализа с толку. Очень трудно понять, получается действительно достоверный результат или ошибочный. Так утверждают многие специалисты. Результаты теста ИГХ наиболее надежны для свежих или замороженных образцов тканей. ИГХ является ненадежным способом тестирования тканей, которые сохраняются в воске или других химических веществах.
Тестирование FISH является предпочтительным способом оценки сохраненных образцов тканей.
- Аналитические факторы – аппаратура и квалификация специалиста также играют роль, и оказывают влияние на достоверность анализа HER2. Чтобы избежать ошибок, необходима регулярная калибровка микроскопов, использование стандартизированных лабораторных процедур, постоянное профессиональное развитие и специализированные программы обучения персонала.
- Постаналитические факторы связаны с интерпретацией результатов анализа, анализом изображений, отчетностью и постоянным обеспечением качества. Интерпретация ИГХ обычно выполняется вручную, включается субъективный фактор и результаты могут варьироваться в зависимости от опыта и бдительности наблюдателя. Например, при анализе ИГХ можно опросить двух патологоанатомов, смотрящих на один и тот же слайд, и один может назвать это 2+ положительное окрашивание, а другой может назвать это 3+ положительное окрашивание.
Оценка с помощью FISH и более новых методов тестирования HER2 CISH, SISH или DDISH, автоматизирована, поэтому является более объективным и количественным, чем с помощью иммуногистохимии. Например, интерпретация теста Fish HER2 – это гораздо более объективный процесс. С помощью анализа FISH патологоанатом подсчитывает фактические копии генов HER2, которые появляются в виде красного “сигнала” в окрашенном в синий цвет ядре раковой клетки, видимом через микроскоп.
Выделяют еще три основных фактора, которые могут привести к неправильному результату:
- Второй анализ на новом срезе фиксированной формалином, залитой парафином ткани, которая поступает из другой части опухоли, может дать другой результат. Хотя такие опухоли встречаются нечасто, но они могут быть HER2-положительными в одних местах и HER2-отрицательными в других.
- Иногда вся хромосома, на которой расположен ген HER2 (наряду с тысячами других генов), амплифицируется в опухолевой ткани. Это называется полисомией хромосомы 17, и ее можно неверно истолковать как амплификацию гена HER2.
- Техническая ошибка в анализе ИГХ (например, если дозатор, который выпускает каплю окрашивающего реагента на предметное стекло, не открывается) может быть обнаружена только путем включения контрольного образца ткани, а он, как известно, набирает 3+ на том же предметном стекле, что и тестируемая ткань. Если такой контрольный образец не используется, отсутствие окрашивания может быть неверно истолковано как отрицательный результат теста. Анализы FISH, в отличие от ИГХ, имеют встроенный контроль для предотвращения ложных отрицательных результатов.
Независимо от того, какой выбран метод определения HER2/neu статуса (иммуногистохимический или с помощью гибридизации FISH, CISH, SISH или DDISH), необходимо, чтобы он был проведен с соблюдением всех требований. Если получен двусмысленный результат, требуется проведение повторного анализа другим методом. Только так можно получить достоверные сведения о статусе HER2. И только таким образом определить возможность проведения таргетной терапии, которая значительно повышает выживаемость пациентов с раком молочной железы.
Продолжение статьи
- Часть 1. Статус HER2 при диагностике опухолей молочных желез. Характеристика. Часть 1.
- Часть 2. Статус HER2 при диагностике опухолей молочных желез. Иммуногистохимическое тестирование. Тесты ISH.
- Часть 3. Ошибки при определении статуса HER2.
Борисова О.В.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Ермолаева А.Г.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Мельникова В.Ю.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Петров А.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ
Славнова Е.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Срочная интраоперационная морфологическая диагностика в онкологии
Авторы:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н.
Как цитировать:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н. Срочная интраоперационная морфологическая диагностика в онкологии. Онкология. Журнал им. П.А. Герцена.
2015;4(4):5‑11.
Volchenko NN, Borisova OV, Ermolaeva AG, Melnikova VYu, Petrov AN, Slavnova EN. Rapid intraoperative morphological diagnosis in oncology. P.A. Herzen Journal of Oncology. 2015;4(4):5‑11. (In Russ.)
https://doi.org/10.17116/onkolog2015445-11

Срочная интраоперационная морфологическая диа-гностика (СИМД) — цитологическая и гистологическая — применяется более 100 лет. В последнее время наблюдается общемировая тенденция к снижению количества срочных морфологических исследований во время операции. Это связано с широким применением минимально инвазивных методов получения материала в дооперационной диагностике с целью морфологической верификации процесса, определения факторов прогноза течения заболевания и показаний к назначению адекватной терапии. Благодаря развитию методов уточняющей морфологической диагностики, таких как иммуногистохимия (ИГХ) и цитохимия, и молекулярно-генетических методов расширяются знания об опухолях. Правильный диагноз возможен только при исследовании всего объема опухоли, включая соответствующие ИГХ и молекулярно-генетические исследования. В связи с применением методов уточняющей диагностики показания для СИМД значительно сокращаются. Однако важность срочного морфологического исследования остается несомненной. СИМД по-прежнему играет важную роль, так как определяет тактику хирурга во время операции, позволяет избежать повторных операций или излишне обширных оперативных вмешательств.
Целью интраоперационной морфологической диагностики является адекватное выполнение хирургического вмешательства. Основными задачами срочного интраоперационного морфологического исследования являются:
1) морфологическая верификация диагноза после нескольких неудачных попыток или невозможности дооперационной диагностики, а также при несоответствии морфологического диагноза операционным находкам;
2) уточнение степени распространенности опухолевого процесса путем изучения зон регионарного метастазирования, близкорасположенных органов, состояния органов высокого риска метастазирования, экссудатов и смывов из серозных оболочек;
3) установление абластичности операционных краев резекции;
4) контроль информативности взятого материала при некоторых диагностических операциях.
СИМД имеет ограниченные возможности для уточнения гистогенеза и степени дифференцировки опухоли, для определения характера опухоли (первичная или метастаз), диагностики опухолей кожи, сарком мягких тканей и костей, злокачественных лимфом, опухолевых узлов полиморфного строения, оценки степени лечебного патоморфоза. Не следует применять СИМД при подозрении на cr in situ или микроинвазию.
Показания для срочного цитологического или гистологического исследования определяет оперирующий хирург. Оба метода имеют свои преимущества и недостатки.
По данным литературы [1—6], точность СИМД в зависимости от объекта исследования составляет от 89% при исследовании лимфатических узлов до 98—99% при других локализациях. Ошибочный диагноз при СИМД возможен как ложноположительный, так и ложноотрицательный. Причинами ложноотрицательного морфологического заключения могут быть регрессия опухоли, вызванная неоадъювантной химиотерапией, некроз, замещение опухолевой ткани новообразованными сосудами, гистиоцитами, лимфоцитами и фиброзом, что может быть неправильно истолковано как хроническое воспаление. Причинами ложноположительных заключений являются резко выраженная пролиферация и реактивные изменения клеточных элементов. Эти ошибки могут быть вызваны неправильным толкованием морфологической картины, низким качеством замороженных срезов, неправильным забором материала для исследования, незнанием макроскопических признаков, сложными случаями для интерпретации, наличием только карциномы in situ в образце, гетерогенностью опухоли.
Следовательно, необходимо понимание различных проблем, с которыми может столкнуться как патологоанатом при исследовании замороженных срезов, так и цитолог при СИМД.
Для качественной интраоперационной морфологической верификации диагноза необходимо получение информативного операционного материала, правильное оформление сопроводительных документов с указанием анамнестических данных, стадии процесса, характера предоперационного лечения, сроков его проведения, макро- и микроскопического исследования операционного материала.
Цель исследования — оценить точность СИМД и проанализировать причины диагностических ошибок.
Материал и методы
В 2013 г. ФГБУ «ФМИЦ им. П.А. Герцена» выполнено 418 срочных гистологических исследований у 361 больного (7% общего количества операций) и 1198 срочных цитологических исследований у 646 (12,5%) больных. В 2014 г. выполнено 507 срочных гистологических исследований у 356 (8%) пациентов и 1356 срочных цитологических исследований у 676 (15,5%) пациентов. Для срочного гистологического исследования применяются криостатные срезы, препараты окрашиваются гематоксилином и эозином. Недостатком криостатных срезов является более низкое качество гистологических препаратов, чем при плановом гистологическом исследовании после приготовления парафиновых блоков. Срочное гистологическое исследование проводится в течение 20—30 мин. Для срочной окраски цитологических препаратов применяют набор для окраски Лейкодиф (Чехия). Срочное цитологическое исследование занимает 10—15 мин. Для исследования экссудатов из серозных полостей и диагностики метастатического поражения лимфатических узлов применяется иммунофлюоресцентное исследование (ИФИ) с антителом к эпителиальному антигену Ber-EP4 FITC («Dako»). ИФИ осуществляется на флюоресцентном микроскопе Carl Zeiss Imager M1.
Результаты
Морфологическая верификация диагноза
Интраоперационная морфологическая верификация диагноза применяется в основном при периферических образованиях легких, недоступных для дооперационного морфологического исследования, при опухолях яичников, а также при неуверенном дооперационном морфологическом диагнозе при опухолях молочной железы. Мы придерживаемся правила — не использовать срочное исследование при cr in situ, так как можно не получить категоричного заключения ни при срочном, ни при плановом исследовании.
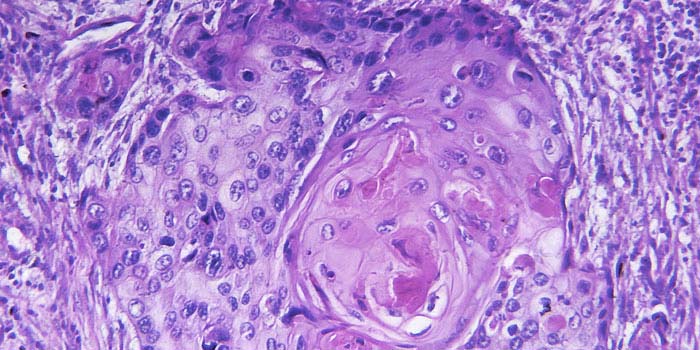
Гистологическая СИМД для верификации процесса в легком позволила установить туберкулез в 32,8%, гамартому в 8,2%, хроническое продуктивное воспаление в 6,6% наблюдений, что дало возможность избежать излишне радикальных операций. Нейроэндокринные опухоли (типичный и атипичный карциноид) выявлены в 8,2% наблюдений (рис. 1, 2 и далее). Злокачественный процесс установлен в 44,3% наблюдений, при этом 85% составила аденокарцинома легкого, преимущественно высокодифференцированная (прежний БАР) (рис. 3), а 14,8% — метастазы аденокарциномы кишечного типа, желудка и меланомы в ткани легкого. Расхождений срочного и планового гистологического исследований не отмечалось.
При срочном цитологическом исследовании образований в легком гиподиагностика составила 6,7% (4 наблюдения из 60), что связано с получением материала из очага некроза, воспаления, а также наличием микроочагов опухоли на фоне пневмонии. В 6,6% наблюдений цитологически было дано неуверенное заключение.
Опухоли яичников всегда подвергаются СИМД с целью верификации диагноза, что обусловлено отсутствием дооперационной морфологической диагностики — опухоли практически не пунктируют из-за опасности диссеминации. Изучение криостатных срезов является важным диагностическим инструментом определения характера поражений яичников. В 30% наблюдений проведено двустороннее исследование яичников. При СИМД сравнительно просто диагностируют неопухолевые поражения яичников, такие как фолликулярная, лютеиновая, эндометриоидная кисты, эндометриоз и т. д. (54,4%). Доброкачественные опухоли яичников диагностированы в 15,8% случаев, пограничные опухоли яичников (ПОЯ) — в 8,5%, злокачественные — в 21,5%. В одном наблюдении при СИМД диагностирована аденокарцинома яичника, а при плановом гистологическом исследовании установлена тератома. Ошибка связана с выраженной пролиферацией и образованием сосочковых структур эпителиального компонента тератомы. СИМД опухолей яичников имеет ряд ограничений, особенно при ПОЯ, которые характеризуются некоторыми гистологическими особенностями — нарушением стратификации эпителиального пласта, увеличением митотической активности, в некоторых случаях ядерной атипией, но отсутствует стромальная инвазия. СИМД опухолей яичников определяет объем оперативного вмешательства. При доброкачественных и ПОЯ можно выполнить органосохраняющее лечение у молодых женщин, в то время как злокачественные эпителиальные опухоли, как правило, требуют обширного хирургического вмешательства с гистерэктомией, двусторонним удалением придатков матки и сальника, а также тазовой и ретроперитонеальной лимфаденэктомией. При исследовании опухолей яичников необходимо тщательное макроскопическое исследование материала в совокупности с клиническими данными и методами инструментального исследования. Желательно исследовать несколько криостатных срезов из разных участков. По нашим данным, ошибка при исследовании ПОЯ яичников имела характер гиподиагностики и составила 7%, что связано в основном с наличием лишь микроочагов опухоли (рис. 4). Большой размер опухоли, двустороннее поражение, а также муцинозный характер являются неблагоприятными факторами в определении злокачественного потенциала при СИМД. В 20% наблюдений при исследовании брюшины при СИМД выявлены импланты ПОЯ. Если имеются инфаркт и некротические изменения, а также киста, лишенная эпителиальной выстилки, окончательные выводы следует делать при плановом гистологическом исследовании на парафиновых блоках. В 14,3% случаев при СИМД выявлены метастазы в яичниках эндометриоидной аденокарциномы, аденокарциномы шейки матки, желудка, молочной железы и почки, подтвержденные плановым гистологическим исследованием.
Таким образом, чувствительность СИМД при опухолях яичников составляет 98,7%, специфичность — 99%.
Срочное цитологическое исследование яичников применяется при пункции кист или при невозможности гистологического исследования. В одном наблюдении при исследовании кисты цитологически имелась гиподиагностика ПОЯ, что связано с объективными трудностями — клеточная атипия отсутствовала. Однако при пересмотре цитологических препаратов имелись плотные опухолевые комплексы из мелких клеток, что характерно для ПОЯ.
СИМД при образованиях молочной железы в настоящее время применяют крайне редко, так как морфологический диагноз является результатом исследования дооперационных трепанобиопсий. При расхождении цитологического и гистологического диагнозов и при неуверенном дооперационном диагнозе проводится срочное морфологическое исследование. Доброкачественные поражения составили 57%, при плановом гистологическом исследовании подтверждены такие процессы, как аденоз, фиброаденома с дисплазией эпителия. Рак молочной железы установлен в 40% (18 наблюдений), из них 33% составил дольковый рак, в 2 наблюдениях выявлена cr in situ, в одном наблюдении имелся тубулярный рак на фоне склерозирующего аденоза (рис. 5). В другом наблюдении при СИМД диагностирована липогранулема, а при плановом гистологическом исследовании выявлен небольшой очаг инвазивного рака без признаков специфичности. Чувствительность интраоперационного гистологического диагноза при раке молочной железы составляет 97%, специфичность — 100%. Неуверенное заключение дается в 1—2% наблюдений. Противопоказаниями к срочному исследованию являются внутрипротоковый и внутридольковый рак (cr in situ), внутрипротоковая папиллома. Высокодифференцированная папиллярная и тубулярная карцинома, отсутствие клеточной атипии при инвазивном дольковом раке часто при СИМД неправильно диагностируются как доброкачественные поражения как при цитологическом, так и гистологическом исследовании. Инвазивный микрососочковый рак и лимфому молочной железы трудно диагностировать при СИМД.
Случаи гипердиагностики в нашем материале не выявлены, но такие ошибки возможны при пролиферирующем папилломатозе и аденоме соска с гиперплазией эпителия протоков соска с формированием железистых и папиллярных структур, особенно с центральным некрозом, что можно ошибочно принять за внутрипротоковый рак; при склерозирующем аденозе с радиальным рубцом, когда создается впечатление инвазивного роста рака; при гранулематозном мастите, эктазии протоков и некрозе жировых клеток. Для избежания морфологической ошибки необходимо тщательное исследование препарата: отсутствие атипии эпителия, наличие миоэпителиального слоя, плотная коллагеновая строма помогают в постановке правильного морфологического диагноза.
Интраоперационно цитологически опухоли молочной железы исследуют крайне редко: при наличии кист и отсутствии дооперационного морфологического диагноза. В нашем исследовании имелось одно наблюдение, когда цитологически диагностирована папиллярная киста молочной железы, а при плановом гистологическом исследовании диагностирован папиллярный рак.
Цитологическая гиподиагностика при исследовании первичной опухоли составила 3,8%, что связано с утратой морфологических особенностей опухолевых клеток, особенно при недифференцированных и мелкоклеточных новообразованиях (например, мелкоклеточный лимфоцитоподобный рак), а также выраженными дистрофическими изменениями опухолевых клеток. Цитологическая гипердиагностика не превысила 1% и связана с выраженными реактивными изменениями эпителия.
Уточнение степени распространенности опухолевого процесса
С развитием интраоперационного ультразвукового исследования, микрохирургических пособий во время операции, позволяющих обнаружить очаги опухоли, невыявленные на дооперационном обследовании, и интраоперационных находок при непосредственной ревизии операционной раны СИМД имеет неоценимые преимущества. Проведение СИМД в 10% случаев изменяет объем оперативного вмешательства [7]. Невозможность выполнения оперативного вмешательства должна быть подтверждена морфологически.
СИМД позволяет объективно оценить состояние лимфатического коллектора. В 30—40% макроскопически неизмененных лимфатических узлов обнаруживают метастазы, а в 25—30% макроскопически похожих на метастатические узлы при микроскопическом исследовании метастазы не выявляют. Срочное интраоперационное гистологическое исследование лимфатических узлов может быть неудачным в 25% наблюдений [7]. Большое количество ложноотрицательных заключений как цитологических, так и гистологических является серьезной проблемой для клинического применения СИМД в основном из-за ограниченной способности обнаруживать микрометастазы, особенно подкапсульные, которые просто не попадают в срез или соскоб с поверхности разрезанного лимфатического узла. Кроме того, возможна потеря отдельных опухолевых клеток при приготовлении гистологического препарата. Чувствительность и специфичность срочного цитологического исследования лимфатических узлов аналогичны исследованию криостатных срезов, поэтому цитологический метод является альтернативой срочному гистологическому исследованию лимфатических узлов.
В нашем центре проведена работа по исследованию лимфатических узлов при радикальной трахелэктомии у пациенток с начальным раком шейки матки [8]. Удаленные лимфатические узлы подвергали срочному цитологическому исследованию. При обнаружении увеличенных и подозрительных по метастатическому поражению тазовых и парааортальных лимфатических узлов срочное цитологическое исследование дополняли или заменяли срочным гистологическим исследованием. По результатам срочного цитологического и гистологического исследования у 5 (6%) пациенток из 81 выявлены метастазы в лимфатических узлах, в связи с чем произведена конверсия трахелэктомии в расширенную экстирпацию матки с удалением или транспозицией придатков. Метастатическое поражение лимфатических узлов во всех случаях было подтверждено при плановом гистологическом исследовании. В 3 случаях установлены микрометастазы (<2 мм), в 2 — макрометастазы. Число положительных лимфатических узлов варьировало от 1 до 5. Во всех наблюдениях отмечались метастазы плоскоклеточного рака [8].
В настоящее время широко применяется СИМД сторожевого (сигнального) лимфатического узла (СЛУ). Метастатическое поражение СЛУ является одним из основных прогностических и предиктивных факторов при раннем раке желудка, шейки матки, молочной железы и меланоме. СЛУ является первым лимфатическим узлом на пути оттока лимфы от первичной опухоли. Отрицательный СЛУ может исключать возможность метастазов в других лимфатических узлах, что не всегда подтверждается на практике. Например, у женщин с ранним раком шейки матки и молочной железы, которые хотят сохранить репродуктивный потенциал, можно избежать радикального хирургического вмешательства, если в сторожевом узле отсутствует метастаз. Исследование СЛУ проведено гистологически у 4 пациенток при раке шейки матки, метастазов не выявлено; цитологически исследовано 3 СЛУ при раке желудка (у 2) и молочной железы (у 1), метастазов не выявлено.
Причинами гиподиагностики является исследование не всех удаленных лимфатических узлов. Оптимально исследуют не более 5 лимфатических узлов из-за ограничения временны́х рамок. Пролиферация гистиоцитарных элементов при синус-гистиоцитозе с наличием крупных полиморфных гистиоцитов может служить причиной гипердиагностики. Для уточнения диагноза используется ИФИ лимфатических узлов, повышающее достоверность цитологической диагностики до 94%.
Часто для уточнения степени распространенности опухолевого процесса исследуются близкорасположенные органы, брюшина.
Важное значение в оценке степени распространенности опухолевого процесса имеет исследование экссудатов из серозных полостей. Остается сложной и нерешенной задачей цитологического исследования диссеминатов с брюшины при перстневидно-клеточном раке желудка из мелких клеток, ПОЯ, так как эти опухоли при микроскопическом исследовании крайне сложно дифференцировать с реактивным мезотелием. Срочное гистологическое исследование в большинстве наблюдений позволяет установить диссеминацию опухоли. Применение ИФИ повышает выявляемость клеток аденогенного рака до 98% (рис. 6, 7). Из исследованных 150 экссудатов при СИМД ИФИ проведено в 17 (11%) наблюдениях, из них наиболее часто при перстневидно-клеточном раке желудка (12 наблюдений) и ПОЯ (4 наблюдения), что позволило установить диссеминацию опухоли в брюшной полости.
Достоверность СИМД метастазов в печени составляет 98%, гиподиагностика отмечена в одном наблюдении из-за резко выраженной деформации материала. Наиболее часто метастазы в печени выявляют при аденокарциноме желудка и толстой кишки.
Установление абластичности операционного края резекции
Для морфологического контроля абластичности хирургического края интраоперационное исследование имеет важное значение, так как связано с расширением показаний для экономных резекций, особенно при раке молочной железы при трахелэктомии и микрохирургических операциях на органах головы и шеи, а также при раке желудка, толстой кишки, легкого и др.
В настоящее время имеется четкая тенденция к уменьшению расстояния между опухолью и краем резекции. В последние годы появились исследования, показывающие, что сокращения края резекции не приводит к увеличению частоты местных рецидивов и ухудшению выживаемости. По мнению многих исследователей, применение лучевой терапии расширяет возможности оперативного вмешательства.
При раке молочной железы патоморфолог, как правило, дает заключение о негативном крае при расположении опухоли от 1 до 5 мм от края резекции; о позитивном крае, если опухолевые клетки присутствуют в исследуемом материале, и о сомнительном или закрытом крае, когда опухолевые клетки располагаются на расстоянии менее 1 мм от края резекции. При раке молочной железы для срочного гистологического исследования доставляется удаленная опухоль и исследуется один или два края ближайших к опухолевому узлу. Из 87 исследованных краев резекции опухоль обнаружена в 12 (13,8%). В 3 (4%) наблюдениях положительный край резекции установлен только при плановом гистологическом исследовании, что потребовало повторной операции. Факторами, определяющими гистологическую гиподиагностику при СИМД, являются обширный внутрипротоковый компонент и инвазивная дольковая карцинома.
При раке молочной железы проводят срочное цитологическое исследование нижнего и верхнего краев резекции, подсосковой зоны, иногда исследуют медиальный и латеральный края. У 2,5% больных в крае резекции обнаружены опухолевые клетки. Ложноотрицательные цитологические заключения составили 1,2%.
Для исследования краев резекции при раке молочной железы часто доставляется жир, а паренхима молочной железы отсутствует, поэтому адекватно оценить абластичность не представляется возможным.
Оценка края резекции при раке желудка рекомендуется для пациентов при T3 или T4 стадии заболевания, интраоперационно исследуют, как правило, проксимальный край резекции. Срочное гистологическое исследование позволило выявить опухолевый рост в крае резекции при раке желудка в 8% наблюдений. Положительный край был обусловлен инвазией опухоли подслизистого слоя, неопределяемой при макроскопическом исследовании (рис. 8).
При резекции легкого гистологическое исследование краев резекции применяется редко, за 2 года всего 11 наблюдений. Опухолевые клетки обнаружены только в одном наблюдении при неходжкинской лимфоме. Цитологически край резекции бронха исследовали в 17 наблюдениях, опухолевые клетки не обнаружены.
При раке пищевода опухолевые клетки по краю резекции обнаружены в 11,5%, в одном наблюдении опухоль по краю резекции выявлена только при плановом гистологическом исследовании.
Для оценки адекватности удаления шейки матки при трахелэктомии, выполняли поперечный срез толщиной 1—2 мм с ее резидуальной части для срочного гистологического исследования. С помощью CytoBrush из сохраняемого отрезка цервикального канала получали материал с последующим проведением интраоперационного цитологического анализа. Положительная граница резекции интраоперационно установлена у 5 (6%) из 81 больной. В одном случае, по данным срочного гистологического исследования, выявили рак in situ по краю резекции, в связи с чем произвели дополнительное дисковидное иссечение шейки матки, что позволило обеспечить отрицательную границу резекции и выполнить органосохраняющую операцию. В остальных 4 случаях произведена конверсия трахелэктомии в расширенную экстирпацию матки с транспозицией яичников. Положительная граница резекции в 2 случаях из 5 обнаружена при аденокарциноме, в 2 случаях при аденоплоскоклеточном раке и лишь в одном случае при плоскоклеточном гистотипе [8].
Исследование краев резекции при раке поджелудочной железы проведено в 6 наблюдениях, из них в 3 гистологически выявлена аденокарцинома.
В нашем центре широко применяется цитологическое исследование краев резекции при операциях на органах головы и шеи — опухолевые клетки выявлены в 6,8% наблюдений.
С целью определения абластичности краев резекции при онкоортопедических операциях исследование костного мозга на криостатных срезах практически не применяется, поэтому используется срочное цитологическое исследование. Достоверность исследования составляет 98,8%.
В целом 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства, чтобы сделать его адекватным.
Контроль информативности взятого материала при некоторых диагностических операциях
При опухолях мягких тканей и костей, средостения диагноз возможен только при комплексном клинико-морфологическом исследовании с обязательным применением методов иммуногистохимии, а также во многих случаях молекулярно-генетических методов исследования. Интраоперационная морфологическая, в основном цитологическая диагностика применяется с целью контроля информативности взятого материала для планового гистологического исследования и по информативности не уступает исследованию замороженных срезов. По данным некоторых авторов, диагноз был бы невозможен без цитологического исследования. Это, как правило, лимфома, плазмоцитома, саркома Юинга, метастатическая карцинома, метастатическая меланома, рак из клеток Меркеля, липосаркома. Для малоклеточных, фиброзных, миксоидных и опухолей из жировой ткани роль цитологического исследования отпечатков ограничена.
Заключение
СИМД остается незаменимой в онкологии, так как способна уточнить информацию о характере патологического процесса, степени его распространения, состояния окружающих тканей и краев резекции, что необходимо при выборе адекватного хирургического вмешательства. Однако, при неясном диагнозе и при небольшом количестве полученного материала не следует любой ценой добиваться интраоперационного морфологического исследования, особенно если речь идет о редких опухолях и неинвазивном раке.
Чувствительность гистологического метода при СИМД составляет 98%, специфичность — 99%, чувствительность цитологического метода при СИМД составляет 95%, специфичность — 96%. Гистологическая гипердиагностика при срочном исследовании составляет 0,5%, гиподиагностика 1%, цитологическая гипердиагностика — 3%, гиподиагностика — 9%. Заключения в предположительной форме при срочном гистологическом исследовании составляют 2%, при цитологическом — 11%. В 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства. Неинформативный материал при срочном исследовании достигает 2—5%, в основном при срочном цитологическом исследовании.
Золотым стандартом морфологического исследования является комплексное цитологическое и гистологическое исследования, которые являются взаимодополняющими. Необходимо подчеркнуть значение междисциплинарного подхода к диагностике, в том числе и интраоперационной, включая клинические данные и результаты инструментальных методов исследования с целью достижения точного диагноза.
Участие авторов:
Концепция и дизайн исследования: Н.Н.В.
Сбор и обработка материала: В.Ю.М., А.Г.Е., О.В.Б., Е.Н.С.
Статистическая обработка: О.В.Б., А.Н.П.
Написание текста: В.Н.Н., О.В.Б.
Редактирование: В.Н.Н.
Конфликт интересов отсутствует.